Localización inmunohistoquímica de receptores de potencial transitorio tipo vaniloide 5 en ameloblastos de ratones Swiss
Immunohistochemical localization of transient receptor potential vanilloid-type 5 in ameloblasts of Swiss mice

Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial-CompartirIgual 4.0.
Mostrar biografía de los autores
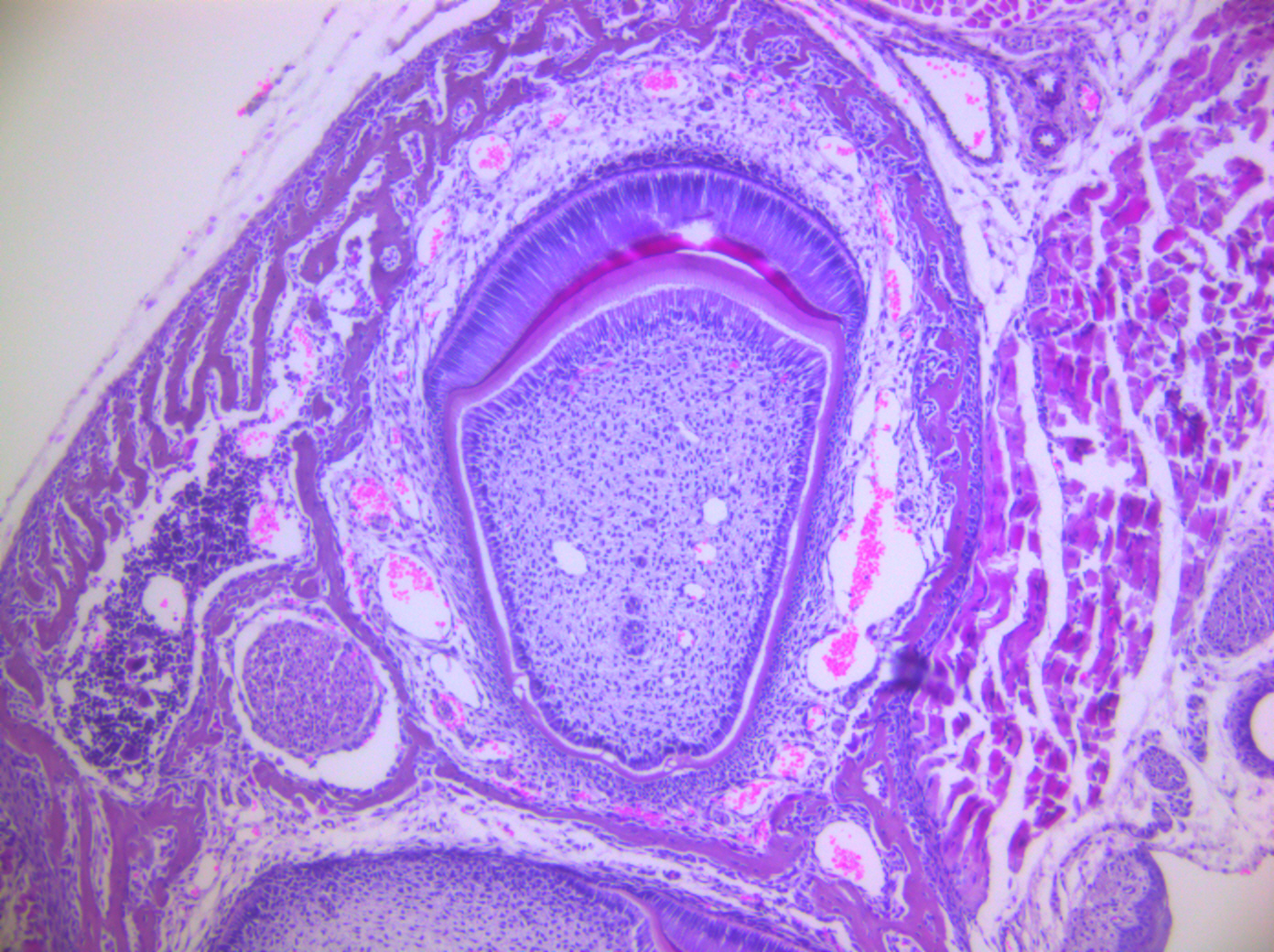
Objetivo. Determinar la localización de los receptores de potencial transitorio de tipo vaniloide-5 (TRPV5) en los ameloblastos de ratones Swiss. Materiales y métodos. Estudio experimental In vitro donde fueron analizados cortes en parafina de 12 incisivos de crecimiento continuo de ratones machos Swiss salvajes de 7 días de nacidos. Las etapas del desarrollo de la formación del esmalte dental se identificaron por medio de la coloración hematoxilina-eosina. La inmunodetención de los receptores de potencial transitorio de tipo vaniloide-5 fue efectuada por medio del anticuerpo primario policlonal anti-TRPV5. Las observaciones se llevaron a cabo mediante un microscopio Leica DM 500. Resultados. Se identificaron las diferentes etapas implicadas en la formación del esmalte dental, entre ellas, la etapa de secreción y maduración. En ellas, se evidenció que los ameloblastos eran células alargadas con núcleos ovalados en posición proximal y con áreas manifiestamente desarrolladas de secreción medial y distal. Fue visualizado un inmunomarcaje de TRPV5 en la membrana plasmática y citoplasma de los ameloblastos de secreción y maduración de todos los ratones analizados. Los TRPV5 también fueron inmunolocalizado en los odontoblastos, endotelio vascular y células pulpares. Conclusiones. Los receptores de potencial transitorio de tipo vaniloide-5 se localizan en los ameloblastos de secreción y maduración de ratones Swiss. Particularmente, los TRPV5 son inmunodetectados en los odontoblastos, endotelio vascular y células de la pulpa dental.
Visitas del artículo 427 | Visitas PDF
Descargas
- Thompson VP. The tooth: An analogue for biomimetic materials design and processing. Dent Mater. 2020; 36(1):25-42. https://doi.org/10.1016/j.dental.2019.08.106
- Bronckers AL. Ion Transport by Ameloblasts during Amelogenesis. J Dent Res. 2017; 96(3):243-253. https://doi.org/10.1177/0022034516681768
- Eckstein M, Aulestia FJ, Nurbaeva MK, Lacruz RS. Altered Ca2+ signaling in enamelopathies. Biochim Biophys Acta Mol Cell Res. 2018; 1865(11 Pt B):1778-1785. https://doi.org/10.1016/j.bbamcr.2018.04.013
- Kim HE, Hong JH. The overview of channels, transporters, and calcium signaling molecules during amelogenesis. Arch Oral Biol. 2018; 93:47-55. https://doi.org/10.1016/j.archoralbio.2018.05.014
- Simmer JP, Papagerakis P, Smith CE, Fisher DC, Rountrey AN, Zheng L, Hu JC. Regulation of dental enamel shape and hardness. J Dent Res. 2010; 89(10):1024-38. https://doi.org/10.1177/0022034510375829
- Peng JB, Suzuki Y, Gyimesi G, Hediger MA. TRPV5 and TRPV6 Calcium-Selective Channels. In: Kozak JA, Putney JW Jr, editors. Calcium Entry Channels in Non-Excitable Cells. Boca Raton (FL): CRC Press/Taylor & Francis; 2018. https://doi.org/10.1201/9781315152592-13
- Simancas-Escorcia V, Guarapo AEN, Camargo MGA de. Genes involucrados en la amelogénesis imperfecta. Parte I. Rev Fac Odontol Univ Antioq. 2018; 30(1):105-120. https://dx.doi.org/10.17533/udea.rfo.v30n1a10
- National Research Council (US) Committee for the Update of the Guide for the Care and Use of Laboratory Animals. Guide for the Care and Use of Laboratory Animals. 8th edition. Washington (DC): National Academies Press (US); 2011. https://doi.org/10.17226/12910
- Na T, Peng JB. TRPV5: a Ca(2+) channel for the fine-tuning of Ca(2+) reabsorption. Handb Exp Pharmacol. 2014; 222:321-357. https://doi.org/10.1007/978-3-642-54215-2_13
- So CL, Milevskiy MJG, Monteith GR. Transient receptor potential cation channel subfamily V and breast cancer. Lab Invest. 2020; 100(2):199-206. https://doi.org/10.1038/s41374-019-0348-0
- Robertson SYT, Wen X, Yin K, Chen J, Smith CE, Paine ML. Multiple Calcium Export Exchangers and Pumps Are a Prominent Feature of Enamel Organ Cells. Front Physiol. 2017; 8:336. https://doi.org/10.3389/fphys.2017.00336
- Harada H, Otsu K. Microdissection and Isolation of Mouse Dental Epithelial Cells of Continuously Growing Mouse Incisors. Methods Mol Biol. 2019; 1922:3-11. https://doi.org/10.1007/978-1-4939-9012-2_1
- Ida-Yonemochi H, Otsu K, Harada H, Ohshima H. Functional Expression of Sodium-Dependent Glucose Transporter in Amelogenesis. J Dent Res. 2020; 99(8):977-986. https://doi.org/10.1177/0022034520916130
- Eckstein M, Lacruz RS. CRAC channels in dental enamel cells. Cell Calcium. 2018; 75:14-20. https://doi.org/10.1016/j.ceca.2018.07.012
- Simancas-Escorcia V, Berdal A, Díaz-Caballero A. Caracterización fenotípica del síndrome amelogénesis imperfecta–nefrocalcinosis: una revisión. Duazary. 2019; 16(1):129. https://doi.org/10.21676/2389783X.2531
- Van der Wijst J, van Goor MK, Schreuder MF, Hoenderop JG. TRPV5 in renal tubular calcium handling and its potential relevance for nephrolithiasis. Kidney Int. 2019; 96(6):1283-1291. https://doi.org/10.1016/j.kint.2019.05.029
- Nie M, Bal MS, Yang Z, Liu J, Rivera C, Wenzel A, Beck BB, Sakhaee K, Marciano DK, Wolf MT. Mucin-1 Increases Renal TRPV5 Activity In Vitro, and Urinary Level Associates with Calcium Nephrolithiasis in Patients. J Am Soc Nephrol. 2016; 27(11):3447-3458. https://doi.org/10.1681/ASN.2015101100
- Diaz Rojas KA, Simancas-Escorcia V. Caracterización fenotípica del Síndrome de Raine. Cienc Salud Virtual. 2019; 11(2):131–142. https://doi.org/10.22519/21455333.1267
- Simancas-Escorcia VH, Natera-Guarapo AE, Acosta de Camargo MG. Genes involucrados en la Amelogénesis Imperfecta. Parte II. Rev Fac Odontol Univ Antioquia. 2019; 30(2). https://doi.org/10.17533/udea.rfo.v30n2a9
- Hossain MZ, Bakri MM, Yahya F, Ando H, Unno S, Kitagawa J. The Role of Transient Receptor Potential (TRP) Channels in the Transduction of Dental Pain. Int J Mol Sci. 2019; 20(3):526. https://doi.org/10.3390/ijms20030526
- Simancas-Escorcia VH. Fisiopatología de los odontoblastos: una revisión. Duazary. 2019; 16(3):87–103. https://doi.org/10.21676/2389783X.2971
- Cho YS, Ryu CH, Won JH, Vang H, Oh SB, Ro JY, Bae YC. Rat odontoblasts may use glutamate to signal dentin injury. Neuroscience. 2016; 335:54-63. https://doi.org/10.1016/j.neuroscience.2016.08.029
- Kim JH, Won J, Oh SB. Expression of CaV3.1 T-type Calcium Channels in Acutely Isolated Adult Rat Odontoblasts. Arch Oral Biol. 2020; 118:104864. https://doi.org/10.1016/j.archoralbio.2020.104864
- Baylie RL, Brayden JE. TRPV channels and vascular function. Acta Physiol (Oxf). 2011; 203(1):99-116. https://doi.org/10.1111/j.1748-1716.2010.02217.x























