



Artículos originales
Caracterización morfométrica de abejas y zánganos (Hymenoptera: Apidae) en una nueva zona de congregación en Boyacá, Colombia
Morphometric characterization of bees and drones (Hymenoptera: Apidae) in a new congregation area in Boyacá, Colombia
Temas Agrarios
Universidad de Córdoba, Colombia
ISSN: 0122-7610
ISSN-e: 2389-9182
Periodicidad: Semestral
vol. 27, núm. 2, 2022
Recepción: 17 Agosto 2023
Aprobación: 24 Agosto 2023

Resumen: El proceso de reproducción de Apis mellifera L. (Hymenoptera: Apidae), se presenta en áreas definidas de congregación donde ocurren los apareamientos naturales y convergen machos y abejas reinas no fecundadas de diversas colonias. Este trabajo se ha enfocado en la identificación y caracterización de una zona de congregación de zánganos en una región biogeográfica del corredor de bosque seco montano bajo, en el valle altoandino de Sugamuxi-Tundama, en virtud a la densidad de colonias de abejas allí establecidas, considerando los factores climáticos de entorno y la descripción de caracteres biométricos de abejas y zánganos recolectados, y que constituye el primer reporte de una zona de congregación para Colombia. En la zona de estudio predominan los periodos secos de verano que se alternan con inviernos cortos, días nublados y frío intenso, con sensaciones térmicas entre 8 y 19°C. La ruta de movimiento de zánganos se estableció con un vehículo de vuelo no tripulado, a través de la interacción entre vehículo y especímenes de abejas. La trayectoria de movimiento de los drones se estableció operando entre 10 y 60 m en dirección Norte-Sur. La actividad de los drones se produce en dos periodos de 10:00 a 12:00 horas y de 15:00 a 17:00 horas, volando regularmente entre ida y vuelta hasta 1 km de radio. Se colectaron especímenes de abejas obreras identificando las líneas africanas, europeas o del Este Europeo y zánganos de dos tipos amarillos y negros evaluando los parámetros biométricos y estimando el factor discriminante. Este trabajo, describe una metodología para monitorear áreas de congregación y se consolida como una herramienta para los apicultores para la conservación de los ecotipos regionales mediante el planeamiento reproductivo de las abejas.
Palabras clave: Diversidad de Abejas, Apicultura, Biometría, Reinas, Reproducción.
Abstract: The reproduction process of Apis mellifera L. (Hymenoptera: Apidae) occurs in defined congregation areas where natural mating occurs and males and unfertilized queen bees from different colonies converge. This work focused on the identification and characterization of a congregation drone zone in a biogeographic region of the low montane dry forest corridor, in the upper Andean valley of Sugamuxi-Tundama, for the density of bee colonies established there, considering the climatic factors of the environment and the description of biometric characters of bees and drones collected, and which constitutes the first report of a congregation zone for Colombia. In the study area, dry summer periods predominate alternating with short winter, cloudy days, and intense cold, with thermal sensations between 8 to 19°C. The drone movement route was established with an unmanned flight vehicle, through the interaction between the vehicle and bee specimens. The path of movement of drones was established operated between 10 and 60 m in North-South direction. Specimens of worker bees were collected identifying African, European, or Eastern European lines and drones of two types, yellow and black, evaluating biometric parameters and estimating the discriminant factor. The activity of the drones, occurs in two periods of 10:00 to 12:00 hours and 15:00 to 17:00 hours, flying regularly between round trips up to a 1 km radius. This work describes a methodology for monitoring congregation areas and consolidates itself as a tool for beekeepers for the conservation of regional ecotypes through bee reproductive planning.
Keywords: Bee diversity, Biometrics, Queens, Reproduction.
INTRODUCCIÓN
La familia Apidae (Hymenoptera), incluye cerca de 50 especies, con hábitat predominante en regiones secas de clima templado a cálido, en nuestro medio es poco lo que se conoce sobre el comportamiento de apareamiento de los insectos de esta familia. El conocimiento actual en términos de estrategia reproductiva, indica que los machos buscan hembras en unos lugares determinados o frecuentan zonas potenciales en épocas concretas durante el año. En la mayoría de las especies de abejas los ciclos vitales de las hembras son similares, esto es emergen de sus celdas de cría, se aparean rápidamente, perdiendo receptividad hacia los machos. El fortalecimiento de las colonias de Apis mellifera, es quizá la actividad más importante en términos de estrategia evolutiva. Cuando la densidad de celdas en proceso de cría es densa, las hembras emergen de manera sincronizada, lo cual favorec el apareamiento con los machos (Brutscher, et al., 2019; Bigio, et al., 2014; Heidinger, et al., 2014; Delaney et al., 2011; Coelho, 1996).
Las abejas de Apis mellifera, viven en colonias con un promedio de 10.000 a 20.000 individuos, con una gran organización cooperativa; una reina responsable de la reproducción, varios zánganos para el apareamiento y abejas estériles sobre las que reside la dinámica de la colonia. Las complejas interacciones sociales de A. mellifera se mantienen por un intrincado sistema de comunicación química, por feromonas mandibulares, principalmente el ácido 9-oxo-2-decenoico (9-ODA), que en el caso de la reina induce al comportamiento y control de las castas dentro de la colonia y actúa como atrayente de zánganos durante los vuelos de apareamiento. Se han identificado pocas feromonas sexuales en himenópteros sociales; el 9-ODA, es la única feromona de atracción de larga distancia reconocida, (Brutscher, et al., 2019; Heidinger, et al., 2014), aunque se ha planteado la existencia de feromonas en glándulas dermales de los terguitos de las reinas. (Slessor, et al., 2005).
Las áreas de congregación de zánganos (ACZ), se remontan a las observaciones de Buttel-Reepen en 1923. El reporte de Gary en 1962, demostró que los zánganos eran atraídos por reinas vírgenes, en vuelos entre 7 y 30 m (Loper, et al., 1992; Zmarlicki y Morse, 1963). Definir el comportamiento de las reinas y zánganos antes y durante el apareamiento, es una actividad que reviste importancia científica y desde el punto de vista estratégico, para el mantenimiento de la variabilidad genética. Las ACZ, tienen un uso práctico para el apareamiento controlado de potenciales programas de cría, la contribución a la reducción de problemas epizootiológicos y a su vez para reducir la endogamia de las colonias (Giray, et al., 2010; Neuman y Carreck, 2010; Mullin, et al., 2010; Aizen y Harder, 2009). Entre los trabajos sobre ACZ, se distingue el trabajo de Muerrle, et al., (2007), que ha revelado la prevalencia de ACZ en dos temporadas consecutivas de apareamiento para la misma zona. En Brasil se identificaron hasta siete ACZ, en cercanía de apiarios comerciales de abejas de líneas europeas o africanizadas, en cuyo caso evaluaron la diversidad genética de los zánganos atrapados (Collet, et al., 2009).
En Puerto Rico, se describió una ACZ en términos de paisajismo, que se acompañó de observaciones sobre la dirección del vuelo de zánganos instalados en el vecindario de colonias de abejas (Galindo-Cardona, et al., 2012). En Argentina, recientemente se reportó la existencia de una ACZ, determinando la movilidad de los zánganos y sus horarios de actividad (Galindo-Cardona, et al., 2017). Se han identificado ACZ, en especies de abejas del género Apis dorsata, que coinciden con la exogamia de los zánganos, teniendo en cuenta su dinámica espacial y temporal (Beaurepaire, et al., 2014). Se han propuesto diversos argumentos en relación a la prevalencia y expansión de las abejas africanizadas y el híbrido resultante; el aspecto de mayor cuestionamiento reside en el desconocimiento de los mecanismos de introgresión de las abejas africanizadas y la dominancia sobre las líneas europeas.
La pérdida e invasión de las ACZ por las abejas africanizadas, pueden ser la causa (Brutscher, et al., 2019; Heidinger, et al., 2014). Las características biométricas o morfométricas de los zánganos en nuestro medio aún no se han considerado variables que permitan la identificación del origen y naturaleza. La determinación de las abejas a nivel de especie se ha realizado mediante el estudio de las estructuras genitales masculinas (Brutscher, et al., 2019). Sin embargo, las descripciones y variaciones dentro de las especies se basan principalmente en los caracteres morfológicos de las abejas obreras, aunque se han realizado estudios biométricos de zánganos de A. mellifera, A. dorsata y A. cerana, no se han realizado en zonas tropicales. Adicionalmente, los estudios relacionados con la identificación de ACZ´s son relevantes si se tiene en cuenta la preocupación creciente generada con el síndrome de desaparición de las abejas.
En Colombia hay desconocimiento sobre las áreas de congregación y apareamiento entre zánganos y reinas. El objetivo de este trabajo se enfoca en la identificación y caracterización de una zona de congregación de zánganos en los valles de Sugamuxi y Tundama en Boyacá propios de la consociación biogeográfica de bosque seco montano bajo (bs-MB), en virtud a la densidad de colonias de abejas establecidas por apicultores, considerando los factores climáticos. Por primera vez para Colombia, se relaciona un estudio para identificación de zonas de congregación correlacionado con variables biométricas de los zánganos colectados en estas regiones.
MATERIALES Y MÉTODOS
Zona de estudio: El entorno biográfico de estudio hace parte del valle de Sugamuxi y Tundama en Boyacá, Colombia, una zona tipo campiña, entre Tibasosa-Duitama, en las inmediaciones del sector la Y, donde predominan condiciones de bosque seco montano bajo (bs-MB: 2538 m.s.n.m), Figura 1, esta es el área de congregación identificada. Las variaciones microclimáticas son típicas de ladera, la vegetación primaria ha sido alterada completamente y predominan plantaciones de eucaliptos. La temperatura varía de 8 a 19°C, algunas veces es menor de 6º, con máximos de hasta 22°C.
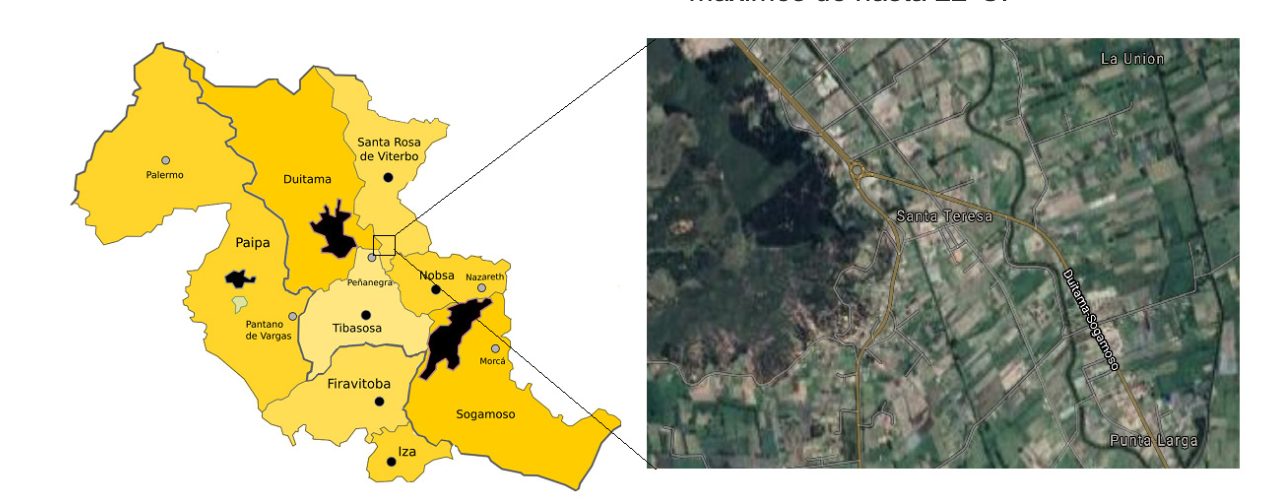
Área de congregación: En el área confluyen diferentes apiarios propios de una amplia estación apícola (Figura 3). Se realizaron actividades de seguimiento y observación directa de la ruta de entrada y salida de zánganos desde las colmenas establecidas en la zona de estudio desde las 9:00 a 12:00 y 14:00 a 17:00, aproximadamente durante 15 días continuos y considerando la intensidad y dirección del viento. Se ajustó una malla conteniendo en su interior una jaula tipo rulo en la que se incluyeron abejas reinas de entre 6 a 7 días de nacidas como atrayente para recolección de zánganos que en conjunto se acopló a un globo de helio. El monitoreo se realizó usando vehículo no tripulado tipo “drone” (PhantomTM DJI 4), entre 10 a 60 m en dirección Norte-Sur.
Biometría de abejas: De apiarios de la zona, se recolectaron abejas obreras de para evaluar sus parámetros biométricos de longitud de ala anterior (LAA), longitud del ala posterior (LAP), longitud de la tibia (LTB), longitud del femur (LFR), índice cubital (IC) y el factor discriminante (Fdm), característicos de líneas A (Africano), C (Europeo) o M (Europa del este), (Figura 2) (Salamanca, 2009). Se colectaron 200 individuos, se dispusieron en frascos de vidrio con alcohol al 70% y se almacenaron a -10ºC hasta el momento de su análisis.
Biometría de zánganos: Del dispositivo del vuelo no tripulado y a través de una red especial adjunta al drone, se recolectaron 108 machos: 24 de color amarillo y 84 negros. Estos machos son representativos del proceso de fecundación de las reinas de Apis mellifera L., ya que se encontraron en la zona de estudio. Los ejemplares se almacenaron a -10ºC en alcohol al 70º hasta el momento del análisis. Los zánganos se disecaron bajo estereoscopio, las partes se dispusieron en portaobjetos y se registraron sus medidas biométricas separando machos amarillos de negros y considerando las variables ancho para el ala anterior (AAA), del ala posterior (AAP), de la cabeza (AC), de la tibia (ANT), del abdomen (ANB), del fémur (ANF), del metatarso (AMT), del tórax (ATX) y del ala anterior (LAA), del ala posterior (LAP), de la cabeza (LC), de la tibia (LTB), del abdomen (LAB), del cuerpo (LLC), del fémur (LFR), del tórax (LTX), del metatarso (LMT), (Figura 2) (Tatsuta, et al., 2018; EL-Kazafy, 2013). De cada una de las secciones del cuerpo detalladas en la Figura 2, se tomaron fotografías digitales para su análisis con el software ImageJ (NHI, USA).
Georreferencia y meteorología: Los monitoreos realizados en la zona de estudio, fueron georeferenciadas con un sistema de posicionamiento global (GPS; GarminTM serie: GPSMAP 78). Los datos meteorológicos de dirección dominante del viento, temperatura y precipitación fueron tomados de la base de datos Meteoblue (https://www.meteoblue.com), para el valle interandino de Sugamuxi-Tundama.
Estadística: Para el grupo de abejas y zánganos recolectados en la zona de congregación, se estimaron los promedios, la desviación estándar y los intervalos de confianza de las variables biométricas consideradas. Además, se realizó un análisis multivariado para componentes principales y los coeficientes de correlación de Pearson para los parámetros biométricos, usando el paquete estadístico JMP® Pro 14.0.

RESULTADOS Y DISCUSIÓN
El área de congregación de zánganos ACZ identificada, corresponde con un área de bosque de eucaliptos, de estructura abierta pero protegida por el viento y con cercanía a otros apiarios establecidos en la en área. Las colmenas instaladas son de tipo Langstroth, con abejas híbridas tendientes a la mansedumbre y para el beneficio de polen principalmente. El uso del drone facilitó la identificación de esta ACZ, ya que por constante avistamiento de diferentes tipos de abejas que no generaron ningun tipo de pillaje, se estableció como un corredor de apareamiento en virtud a la presencia de zánganos registrados en los videos. La ACZ es propia de la consociación de bosque seco montano bajo (bs-MB), localizada entre los valles de Sugamuxi y Tundama, ubicado entre los 5º47`44” LN 73º00`10” LO a 5º47`34” LN 73º34`56” LO y 5º47`43” 73º00`01” a 5º47`43” 73º00`01” y que se constituye en el primer reporte de una ACZ para Colombia. La disposición de los apiarios en la zona de congregación corresponde a una separación media de 450 m. en medio del bosque de eucalipto (Figura 3).
El apareamiento en la ACZ, se presenta principalmente, en horas de la tarde entre 15 a 60 m de altura y con una estimación media de la velocidad del viento de hasta 12 km h-1.
La posición geográfica de la zona de estudio permitió la captación de la energía solar, con un efecto incidente de vientos desde y hacia el valle, que regulan la temperatura del entorno. La intensidad del flujo, es dependiente de las variaciones térmicas diurnas y de enfriamiento nocturno, que se enmarcan en un ligero efecto tipo Fohen, por calentamiento del aire producido al descender por las vertientes de las montañas opuestas a la dirección de los vientos. En la zona de estudio los periodos secos de verano, se presentan en una franja corta, los inviernos cortos con días nublados e intenso frio. La condición térmica oscila entre 8 a 19°C, algunas veces entre 6 a 8°C. La actividad de zánganos mostró dos picos de 10:00 a 12:00 y de 15:00 a 17:00 horas volando de manera regular entre ida y vuelta hasta 1 km de radio.
La velocidad y dirección del viento es variable oscila entre 1 a 19 km h-1, con dirección norte sur este y este sur, con un perfil de rosa de los vientos (N/SE/ESE). La condición climática en términos de precipitación, es del orden de los 1168 mm/año, que se presenta de manera bimodal, con máximos en los meses de marzo a mayo, parte de octubre y hasta diciembre, con elevada nubosidad en estos mismos meses. En junio y hasta octubre se presentan vientos hasta de 20 km h-1. En todo sistema productivo se suelen considerar las características de las especies animales involucradas en el proceso, en este caso los zánganos. Las condiciones climáticas asociadas a la zona de congregación de la zona de estudio, no son ajenas al proceso de africanización (Salamanca, 2009).

Las variables biométricas LAA, LAP, LTB, LFR, IC y la función Fdm-Discriminante (Daly y Balling, 1978) de abejas recolectadas en la zona de estudio, son comparables con las líneas genéticas europeas tipo Carniola, Ligústica y las africanizadas (Tabla 1). El factor discriminante evidencia los rasgos que caracterizan los tipos de abejas analizadas, puesto que son abejas híbridas que se han venido entrecruzando genéticamente en el tiempo (Gómez, et al, 2021; Urbina-Romero, et al, 2019).
Los valores medios e intervalos de confianza asociados a los parámetros biométricos de zánganos se recogen en la Tabla 2. La longitud del cuerpo de los zánganos osciló entre 15,8 a 16,6 mm para los grupos de machos negros y amarillos, respectivamente. Los parámetros biométricos de LAA y LAP, así como el AAA y AAP, que son indicadores de capacidad de vuelo, fueron mayores en el grupo de zánganos amarrillos (10,7/7,20 y 3,50/3,36 mm), en relación a los valores observados en los negros (10,5/7,15 y 3,47/3,10 mm). En esta misma secuencia los valores de capacidad torácica expresados en LTX y ATX, fue menor para el grupo negro (6,07/5,71 mm), respecto de los amarillos (6,28/5,89 mm); la capacidad del abdomen expresada en el LAB y ANB, siguió la misma secuencia con 7,95/6,01 y 7,14/5,85 mm. Los valores de LAA/AAA son menores que los observados con zánganos africanizados de la Península de Yucatan (11,5/3,83 mm) y Europeos de Baja California en México (11,8/3,89 mm) (De May-Itzá, et al, 2001) y son comparables con los zánganos del Himalaya con valores de (10,0/3,08 mm) reportados por Pathania, et al., 2022.
| Variable | AP-1 | AP-2 | AP-3 | AF | Carniola | Ligústica |
| M ± ds | M ± ds | M ± ds | M ± ds | M ± ds | M ± ds | |
| LAA | 9,12 ± 0,17 | 9,05 ± 0,14 | 9,21 ± 0,24 | 8,58 ± 0,14 | 9,44 ± 0,29 | 9,42 ± 0,18 |
| LAP | 4,22 ± 0,08 | 4,40 ± 0,67 | 4,28 ± 0,11 | 4,12 ± 0,08 | - | - |
| LTB | 2,85 ±0,12 | 2,92 ± 0,11 | 2,97 ± 0,11 | 2,96 ± 0,16 | - | - |
| LFR | 2,61 ±0,16 | 2,48 ± 0,09 | 2,44 ± 0,10 | 2,49 ± 0,08 | 2,50 ± 0,08 | 2,54 ± 0,08 |
| IC | 1,99 ±0,29 | 2,17 ± 0,29 | 2,24 ± 0,14 | 2,13 ± 0,30 | 2,03 ± 0,27 | 1,91 ± 0,25 |
| Fdm | 18,6 ±0,10 | 23,3 ± 0,17 | 25,5 ± 0,22 | - | - | - |
| PB M ± ds | Negros IC | Amarillos IC | |||||
| LCI | LCS | M ± ds | LCI | LCS | |||
| Ancho ala anterior | AAA | 3,47 ± 0,41 | 3,38 | 3,56 | 3,50 ± 0,33 | 3,35 | 3,63 |
| Ancho ala posterior | AAP | 3,10 ± 0,46 | 3,00 | 3,20 | 3,36 ± 0,46 | 3,16 | 3,55 |
| Ancho de la cabeza | AC | 4,51 ± 0,27 | 4,45 | 4,57 | 4,52 ± 0,15 | 4,46 | 4,60 |
| Ancho de la tibia | ANT | 1,03 ± 0,13 | 0,99 | 1,05 | 1,03 ± 0,13 | 0,96 | 1,08 |
| Ancho del abdomen | ANB | 5,85 ± 0,40 | 5,76 | 5,93 | 6,01 ± 0,20 | 5,90 | 6,10 |
| Ancho del femur | ANF | 0,70 ± 0,07 | 0,68 | 0,71 | 0,67 ± 0,10 | 0,63 | 0,72 |
| Ancho del metatarso | AMT | 1,25 ± 0,13 | 1,22 | 1,28 | 1,22 ± 0,14 | 1,16 | 1,27 |
| Ancho del torax | ATX | 5,71 ± 0,36 | 5,63 | 5,80 | 5,89 ± 0,29 | 5,76 | 6,01 |
| Longitud ala anterior | LAA | 10,5 ± 0,78 | 10,3 | 10,6 | 10,7 ± 0,87 | 10,3 | 11,0 |
| Longitud ala posterior | LAP | 7,15 ± 0,61 | 7,00 | 7,30 | 7,20 ± 0,49 | 7,00 | 7,40 |
| Longitud de la cabeza | LC | 2,45 ± 0,43 | 2,36 | 2,55 | 2,35 ± 0,42 | 2,18 | 2,53 |
| Longitud de la tibia | LTB | 3,42 ± 0,47 | 3,32 | 3,53 | 3,35 ± 0,03 | 3,22 | 3,47 |
| Longitud del abdomen | LAB | 7,14 ± 0,47 | 7,03 | 7,24 | 7,95 ± 1,13 | 7,47 | 8,42 |
| Longitud del cuerpo | LLC | 15,8 ± 0,87 | 15,6 | 15,9 | 16,6 ± 0,97 | 16,1 | 17,0 |
| Longitud del femur | LFR | 3,36 ± 0,50 | 3,25 | 3,47 | 3,40 ± 0,27 | 3,28 | 3,52 |
| Longitud del torax | LTX | 6,07 ± 0,46 | 5,97 | 6,07 | 6,28 ± 0,28 | 6,16 | 6,40 |
| Longitud metatarso | LMT | 2,37 ± 0,30 | 2,30 | 2,44 | 2,24 ± 0,23 | 2,14 | 2,34 |
Los resultados del análisis estadístico multivariado de 17 parámetros biométricos, arrojaron cuatro valores propios, que explican el 68,1% de las variaciones entre grupos de zánganos negros y amarillos. En el componente 1 (Longitud del cuerpo, Longitud de la tibia, el torax en longitud y ancho), en la componente 2 (Longitud y anco del ala anterior y ancho ala posterior), que junto a los parámetros restantes explican el 19,5 % de las variaciones observadas. Los parámetros biométricos observados en los zánganos colectados en zona de congregación, son indicativos de un alto grado de correlación positiva y significativa entre las siguientes variables (LAB/LLC), (ANB/LLC) y (LAB/ ANB), (ANB/ATX), (LAA/FFR), (LAP/LTB) y (LTB/LMT), Tabla 3. Estas correlaciones dan robusticidad a los análisis presentados, sin embargo, es necesario indicar que no se conocen caracterizaciones morfométricas amplias para zánganos en Colombia, siendo este el primer trabajo en considerarlas.
| LLC | LAB | ANB | LTX | ATX | LC | AC | LAA | AAA | LAP | AAP | LFR | ANF | LTB | ANT | LMT | AMT | |
| LLC | 1,00 | ||||||||||||||||
| LAB | 0,66 | 1,00 | |||||||||||||||
| ANB | 0,66 | 0,54 | 1,00 | ||||||||||||||
| LTX | 0,54 | 0,18 | 0,49 | 1,00 | |||||||||||||
| ATX | 0,61 | 0,43 | 0,66 | 0,38 | 1,00 | ||||||||||||
| LC | 0,44 | 0,07 | 0,12 | -0,05 | 0,27 | 1,00 | |||||||||||
| AC | 0,22 | 0,26 | 0,51 | 0,36 | 0,48 | -0,12 | 1,00 | ||||||||||
| LAA | 0,22 | 0,13 | -0,16 | -0,02 | -0,29 | 0,11 | -0,31 | 1,00 | |||||||||
| AAA | 0,24 | 0,11 | -0,17 | 0,10 | -0,21 | 0,07 | -0,24 | 0,69 | 1,00 | ||||||||
| LAP | 0,17 | 0,25 | -0,15 | 0,01 | -0,31 | -0,11 | -0,22 | 0,79 | 0,62 | 1,00 | |||||||
| AAP | 0,06 | -0,01 | -0,26 | -0,01 | -0,40 | 0,06 | -0,47 | 0,77 | 0,65 | 0,72 | 1,00 | ||||||
| LFR | 0,10 | 0,22 | -0,16 | -0,18 | -0,24 | -0,06 | -0,26 | 0,66 | 0,49 | 0,77 | 0,61 | 1,00 | |||||
| ANF | 0,00 | 0,08 | 0,06 | -0,22 | -0,02 | 0,06 | -0,02 | 0,11 | -0,09 | 0,20 | 0,08 | 0,36 | 1,00 | ||||
| LTB | 0,14 | 0,24 | -0,10 | -0,23 | -0,20 | 0,00 | -0,27 | 0,65 | 0,32 | 0,68 | 0,55 | 0,87 | 0,39 | 1,00 | |||
| ANT | 0,17 | 0,19 | 0,00 | -0,15 | -0,05 | 0,12 | -0,12 | 0,48 | 0,20 | 0,44 | 0,41 | 0,66 | 0,36 | 0,73 | 1,00 | ||
| LMT | 0,22 | 0,24 | 0,010 | -0,16 | -0,12 | 0,03 | -0,17 | 0,61 | 0,23 | 0,60 | 0,48 | 0,75 | 0,38 | 0,91 | 0,70 | 1,00 | |
| AMT | 0,15 | 0,24 | -0,06 | -0,27 | -0,09 | 0,07 | -0,17 | 0,52 | 0,20 | 0,53 | 0,45 | 0,75 | 0,42 | 0,86 | 0,71 | 0,84 | 1,00 |
La evaluación y estudio de los entornos apícolas, su relación y dependencia de factores de entorno en las áreas de congregación de zánganos (ACZ), permite de alguna manera comprender el comportamiento de las abejas y son aspectos fundamentales en los programas de apareamiento dirigido o controlado genéticamente, usando zánganos de razas preferenciales en procesos sistemáticos bien controlados. La reproducción natural de las abejas en las ACZ, se da de manera libre con la visita de machos y reinas integrantes de varias colonias (Galindo-Cardona, et al., 2017), esta información se correlaciona con lo evidenciado en este trabajo, pues de las mallas dispuestas en la ACZ, se identificaron ejemplares machos que fueron aislados y separados en dos tonalidades de color (amarillos y negros), que evidencia la diversidad genética a partir de zánganos que emergen de colonias de abejas vecinas y que concuerda con los estudios de Galindo- Cardona et al, 2017; Beaurepaire, et al., 2014 y Collet, et al., 2009.
Las congregaciones de machos, son relevantes en la estructura genética de las nuevas colonias de abejas en una zona biogeográfica determinada. La estrategia reproductiva de Apis mellifera L., consiste en minimizar el tiempo de apareamiento, realizando la menor cantidad de vuelos nupciales de la reina hasta aparearse con el mayor número posible de zánganos. Los estudios de apareamiento de las abejas, han sido relativamente pocos y la mayoría son más descriptivos que cuantitativos. Una de las limitantes en el análisis del proceso de apareamiento y muestreo de zánganos, es la altura de los vuelos entre 10 a 40 m y la velocidad de estas actividades (Kocher, et al., 2015; Medina, et al., 2018), ya que las ACZ son el lugar ideal para estudiar la reproducción de abejas bajo condiciones naturales ya que cientos de machos de varias colonias se reúnen en la misma área geográfica para el aprovechamiento del apareamiento, gracias a las feromonas emitidas por las abejas y que se distinguen a kilómetros de distancia (Galindo-Cardona, et al., 2012; Koeniger, et al., 2005).
La existencia de ACZ, son entonces la mejor estrategia para la reproducción y mantenimiento de la especie (Neuman y Carreck, 2010). En este trabajo, se evidencia la convergencia de diferentes tipos de zánganos con su propia variabilidad genética, permitiendo la diversidad para el sostenimiento de la especie en condiciones naturales, ligadas de una parte a factores medioambientales, con la dispersión de hormonas de atracción y al perímetro de distribución de las colonias a lo largo de la zonas de congregación, aspectos reportados por otros investigadores (Mullin, et al., 2010; Aizen y Harder, 2009; Oldroyd, 2007, Schlüns, et al., 2005 y Koeniger, et al., 2005). En condiciones tropicales, la población de A. mellifera L., ha mostrado diferentes grados de entrecruzamiento tal como lo describen los investigadores Gómez et al, 2021; Urbina-Romero, et al., 2019; Medina-Flores, et al., 2015; Guzmán-Novoa, et al., 2011; Prada, et al, 2009 y Salamanca, 2009.
En este trabajo, los parámetros biométricos para LAA, AAA y AAP, LFR, ANF y ANT, de las abejas establecidas en la ACZ, se presentan como hallazgos útiles que ayudan a establecer caracterizaciones moleculares. La LFR de las abejas del estudio son de 2,61± 0,16 mm, más altos que los valores reportados en abejas de la Isla Múcura en Colombia, identificadas como africanizadas con valores de 2,36 ± 0,12 mm (Uribe et al, 2012). La variable LAP en este estudio fue de 4,22 ± 0,08 (AP-1), 4,40 ± 0,67 (AP-2) y 4,28 ± 0,11mm (AP-3) que comparados con los de datos de Uribe, et al (2012), resultaron menores, así como los valores de LTB, que fueron de 2,85 ± 0,12 mm (AP-1) y 2,97 ± 0,11mm (AP-3), respecto al patrón de las abejas insulares. Sin embargo, la biometría observada para LAA, en este trabajo, corresponde con 9,12 ± 0,17 (AP-1), 9,05 ± 0,14 (AP-2) y 9,21 ± 0,24 (AP-3) que difieren de manera significativa de los valores observados en líneas europeas establecidas en San Andrés Isla, Colombia (Torres, et al., 2014), cuyos valores han sido 9,61 ± 0,20 y que son mayores en relación con los observados en abejas africanizadas de la Isla Múcura (Uribe, et al., 2012). Comparando, los resultados de la biometría del estudio en relación a muestras de zánganos Egipcios, se observan diferencias significativas en las variables LAA: 12,0 ± 0,26, LTB: 3,83 ± 0,14 y LFR: 3,28 ± 0,10 (Mazeed, 2011).
Los zánganos, participan en el proceso de fecundación, reproducción y continuidad de la especie y nacen de huevos sin fecundar mediante partenogénesis. En la fecundación de las reinas se fija la condición de variabilidad y comportamiento de la progenie en función del aporte genético de los machos y el carácter heredable por parte de los zánganos, se consolida como una estrategia de control en la reducción del impacto de la africanización en las ACZ. Los estudios sobre diversidad de las ACZ de abejas africanizadas y europeas parecen tener una estructura genética bien diferente (Collet,et al., 2009). Estas descripciones, son indicativas de que el grupo de abejas y zánganos de la zona altoandina en el valle de las provincias de Sugamuxi y Tundama, presentan características híbridas de estructura europea con menor vigor africanizado.
Las ACZ donde se congregan reinas no fecundadas y zánganos de Apis mellifera L., corresponden a zonas biogeográficas donde se disponen sistemas de producción apícola y ocurren constantemente apareamientos y la zona de bs-MB de la zona de estudio es una de ellas. Por lo tanto, estas áreas especiales, son estrategicas para el aprovechamiento del control y mantenimiento natural de Apis mellifera en el tiempo ya que los zánganos de diversas colonias estarán juntos, asegurando una mezcla de gran variabilidad genética para la reina, evitando la endogamia y que se genere un cuello de botella.
CONCLUSIONES
En este trabajo, se describe y reporta la primera zona de congregación de zánganos para fecundación natural de reinas vírgenes, que se monitoreó a través de un vehículo de vuelo no tripulado. La zona corresponde a la consociación de bosque seco montano bajo (bs-MB), caracterizado por una gran densidad de eucaliptos, con una estructura abierta protegida por el viento y con cercanía a otros apiarios establecidos en la zona de estudio. Se identificó la actividad de dos tipos de zánganos (negros y amarillos), con dos periodos de vuelo y horas durante el día entre ida y regreso, que evidencian la variabilidad genética que se encuentra en la ACZ. En el estudio, se pudo evaluar la velocidad y dirección del viento como condición de referencia para la actividad de los zánganos, así como los parámetros térmicos de entorno. Las valoraciones biométricas de las abejas y zánganos recolectados en la zona de estudio, permitieron generar diferenciación entre grupos de zánganos que participan en los procesos de fecundación natural. Las medias e intervalos de confianza asociados a las variables biométricas de zánganos amarillos y negros, arrojaron cuatro valores propios, que explican las variaciones entre grupos de machos. Este trabajo es de particular interés, puesto que relaciona una metodología especial para conocer un área de congregación (ACZ) y se consolida como una herramienta a los apicultores para la conservación de los ecotipos de abejas regionales mediante el planeamiento reproductivo y fecundación natural para que se disponga de una variabilidad genética con vigores híbridos y que reduzcan los niveles de africanización, además el trabajo propende por la identificación de nuevas zonas de congregación en Colombia.
CONTRIBUCIÓN DE LOS AUTORES
GSG: Implementación metodológica para la identificación de áreas de congregación de abejas y zánganos. Evaluación y análisis de resultados, revisión bibliográfica, planeación y redacción del manuscrito. MPOT: captura de zánganos y grupos de abejas con destino al análisis morfométrico, revisión de la literatura, ajuste y redacción del documento final. MJAN: Evaluación biométrica de especímenes de zánganos y abejas de colonias establecidas en la zona de estudio. Revisión bibliográfica y ajustes del manuscrito final.
REFERENCIAS
Aizen, M.A. and Harder, L.D. 2009. The global stock of domesticated honey bees is growing slower than agricultural demand for pollination. Current Biology. 19: 915-918.
Bigio, G., Toufailia, H.A., Hughes, WO.H. and Ratnieks, F.L.W. 2014. The effect of one generation of controlled mating on the expression of hygienic behaviour in honey bees. Journal of Apicultural Research. 53 (5): 563-568.
Beaurepaire, A., Kraus, B., Koeniger, G., koeniger, N., Lim, H. and Moritz, R. 2014. Extensive population admixture on drone congregation areas of the giant honeybee, Apis dorsata.Fabricius, 1793). Ecology and Evolution. 4 (24): 4669-4677.
Brutscher, L.M. Baer, B. and Niño, E. 2019. Putative Drone Copulation Factors Regulating Honey Bee (Apis mellifera) Queen Reproduction and Health: A Review. Insects. 10 (8): 1-18.
Coelho, J.R. 1996. The flight characteristics of drones in relation to mating. BeeScience. 4 (1): 1-22.
Collet, T., Cristino, A.S., Quiroga, C.F., Soares, A.E., Del Lama, M.A. 2009. Genetic structure of drone congregation areas of Africanized honeybees in southern Brazil. Genetics and Molecular Biology. 32: 857-863.
De May-Itzá, W., Quezada-Euán, J., Iuit, L. and Echazarreta, C. 2001. Do morphmetrics and allozymes reliably distinguish Africanized and European Apis mellifera drones in subtropical México?. Journal of Apicultural Research. 40 (1): 17-23.
Delaney, D.A., Keller, J.J., Caren, J.R. and Tarpy, D.R. 2011. The physical, insemination, and reproductive quality of honey bee queens (Apis mellifera L.). Apidologie. 42: 1-13.
Kocher, S. D., Tsuruda, J. M., Gibson, J. D. and Emore, C. M., Arechavaleta-Ve- lasco, M. E., Queller, D. C., Hunt, G. J. 2015. A search for parent-of-origin effects on honey bee gene expression. G3: Genes, Genomes, Genetics. 5 (8): 1657-1662.
Koeniger, N., Koeniger, G. and Pechhack-er, H. 2005. The nearer the better? Drones (Apis mellifera) prefer nearer drone congregation areas. Insectes Sociaux. 52: 31-35.
Galindo-Cardona, A., Monmany A.C., Moreno-Jackson, R., Rivera-Rivera, C., Huertas-Dones, C., Caicedo- Quiroga, L. and Giray, T. 2012. Landscape analyses of drone congregation areas of the honey bee Apis mellifera. Journal of Insect Science. 12, I22:1-15.
Galindo-Cardona, A., Quiroga, O.B., Bianchi, E. and Ayup, M.M. 2017. Primer reporte de un área de congregación de zánganos de Apis mellifera (Hymenoptera: Apidae) de Argentina. Revista de la Sociedad Entomológica Argentina.76,(1-2):50-53.
Giray, T., Oskay, D., Doke, M.A., Kence, A. and Kence, M. 2010. Colony losses survey in Turkey and causes of bee deaths. Apidologie. 41: 451-453.
Gomez, J., Argüello, O., Vásquez, P., Hernández, L. and Payró, E. 2021. Morphometric and molecular analysis (mtDNA) of honeybees (Apis mellifera) in the state of Tabasco, Mexico. Revista Mexicana de Ciencias Pecuarias. 12 (4): 1188-1206.
Guzmán-Novoa, E., Correa-Benítez, A., Guzmán, G. and Espinosa, L.G. 2011. History, colonization and impact of the africanized honey bee in Mexico. Veterinaria México. 42 (2): 149-178.
Heidinger, I.M.M., Meixner, M.D., Berg, S. and Büchler, R. 2014. Observation of the Mating Behavior of Honey Bee (Apis mellifera L.) Queens Using Radio-Frequency Identification (RFID): Factors Influencing the Duration and Frequency of Nuptial Flights. Insects. 5, 513-527.
Loper, G.M., Wolf, W.W. and Taylor, O.R. 1992. Honey bee drone flyways and congregation areas radar observations. Journal of the Kansas Entomological Society. 65: 223-230.
Oldroyd, B.P. 2007. What’s killing American honey bees?. PLoS Biology. 5: 1195-1199.
Mazeed, A.M. 2011. Morphometry and number of spermatozoa in drone honeybees (Hymenoptera: Apidae) reared under different conditions. European Journal of Entomology. 108: 673-676.
Medina, R.G., Paxton, R.J., De Luna, E., Fleites-Ayil, F.A., Medina, L.A.M. and Quezada-Euán, J.J.G. 2018. Developmental stability, age at onset of foraging and longevity of Africanized honey bees (Apis mellifera L.) under heat stress (Hymenoptera: Apidae). Journal of Thermal Biology. 74, 214-225.
Medina-Flores, C.A., Guzmán-Novoa, E., Hamiduzzaman, M.M., Aguilera- Soto, J. and López-Carlos, M.A. 2015. Africanización de colonias de abejas melíferas (Apis mellifera) en tres regiones climáticas del norte de México. Veterinaria México OA. 2 (4):1-9.
Muerrle, T., Hepburn, H.R. and Radloff, S. 2007. Experimental determination of drone congregation areas for Apis mellifera capensis Esch. Journal of Apicultural Research. 46 (3): 154-159.
Mullin, C.A., Frazier, M., Frazier, J.L., Ashcraft, S., Simonds, R., Van Engelsdorp, D. and Pettis, J.S. 2010. High levels of miticides and agrochemicals in North American apiaries: implications for honey bee health. PLoS One. 5: e9754.
Neumann, P., Carreck, N. 2010. Honey bee colony losses. Journal of Apicultural Research. 49: 1-6.
Salamanca, G. G. 2009. Variabilidad genética del ADN mitocondrial de poblaciones de abejas Apis mellifera (Hymenoptera: Apidae) en Colombia. Zootecnia Tropical. 27 (4): 373-382.
Schlüns, H., Moritz, R.F.A., Neumann, P., Kryger, P. and Koeniger, G. 2005. Multiple nuptial flights, sperm transfer and the evolution of extreme polyandry in honeybee queens. Animal Behavior. 70: 125-131.
Slessor, K.N., Winston, M.L. and Le Conte, Y. 2005. Pheromone communication in the honeybee (Apis mellifera L.). Journal of Chemical Ecology. 31: 2731-2745.
Phatania, A., Kumar, A. and Dhima, S. 2022. Morphometrics of Apis mellifera in North –Western Himalayan region of Himachal Pradesh, India. Journal of Entomology and Zoology Studies. 10 (3): 105-109.
Prada, F., Duran, J., Salamanca, G. and Del Lama, A. 2009. Population genetics of Apis mellifera L. (Hymenoptera. Apidae) from Colombia. Journal of Apicultural Research. 48 (1). 3-10.
Tatsuta, H., Takahashi, K.H. and Sakamaki, Y. 2018. Geometric morphometrics in entomology: Basics and applications. Entomological Science. 21: 164-184.
Taha, E. K. A. and Al-Kahtani, S. 2013. Relationship between population size and productivity of honeybee colonies. Journal of Entomology. 10(3): 163-169.
Torres, A.L., Ruiz, J., Chávez, J.M., Osorio, T.M.P. and Salamanca, G.G. 2014. Valoración biométrica de poblaciones de abeja Apis mellifera (Hymenoptera: Apidae) de San Andrés Isla, Colombia. Revista de la Asociación Colombiana de Ciencias Biológicas. 26 (1): 296.
Urbina-Romero, R.A., Utrera-Quintana, F., Castillo-González, F., Livera-Muñoz, M., Benítez-Riquelme, I., Villa-Mancera, A.E., Hernández-Hernández, J.E. and Silva-Rojas, H.V. 2019. Valoración del origen africanizado en la integración de una población experimental de Apis mellifera L. Revista fitotecnia mexicana. 42 (2): 111-118.
Uribe, D.L., Osorio, T.M.P. and Salamanca, G.G. 2012. Análisis morfométrico y grado de africanización de las abejas Apis mellifera L. (Hymenoptera: Apidae) de la Isla Múcura Archipielago de San Bernardo, Colombia. XLVII Congreso Nacional de Ciencias Biológicas. Revista de la Asociación Colombiana de Ciencias Biológicas. 24 (1): 6-7.
Zmarlicki, C., Morse, R.A. 1963. Drone congregation areas. Journal of Apicultural Research. 2: 64-66.
Notas

