ACTIVIDAD ENTOMOPATOGÉNICA DE AISLAMIENTOS
AUTÓCTONOS DE Beauveria spp. SOBRE Premnotrypes vorax
(HUSTACHE) IN VITRO.
ENTOMOPATOGENIC ACTIVITY OF NATIVE Beauveria spp.
ISOLATES AGAINST Premnotrypes vorax (HUSTACHE).
Jorge E. Villamil[1] John W. Martínez[2], Elberth H. Pinzón[3]
Recibido para publicación: Enero 15 de 2015 - Aceptado para publicación: Mayo 25 de 2015
RESUMEN
El gusano blanco (Premnotrypes vorax Hustache.) es una plaga clave en el cultivo de papa en Colombia, debido a las pérdidas en calidad del tubérculo las cuales pueden llegar hasta el 100% dependiendo del nivel de población y manejo del cultivo. La investigación tuvo como finalidad evaluar in vitro aislamientos autóctonos de Beauveria sp. sobre P. vorax. Los aislamientos fueron obtenidos de larvas y adultos infectados de Premnotrypes vorax, Tecia solanivora, Phthorimaea operculella, Aepytus sp., Hypotenemus hampei y Rynchophorus palmarum, colectados en campo y aislados con técnicas In vitro. De ocho aislamientos obtenidos de Beauveria sp, se seleccionaron cinco (Bv01, Bv02, Bv05, Bv07 y Bv08) por presentar un porcentaje de mortalidad superior al 60% sobre larvas de P. vorax. La evaluación de eficacia se realizó en diez larvas de P. vorax. Las larvas se desinfectaron y sumergieron en una suspensión de 1x107 esporas.mL-1, se realizaron observaciones por 16 días, cada 48 horas evaluando porcentaje de mortalidad. Se empleó un diseño completamente al azar, con seis tratamientos y cuatro repeticiones. Los resultados mostraron que 16 días después de la inoculación, se presentó el 100% de mortalidad de las larvas para los cinco aislamientos, siendo el aislamiento Bv07 el que presentó la mayor actividad patogénica sobre P. vorax In vitro.
Palabras claves: hongos, larvas, entomopatógeno, mortalidad, cultivo de papa.
ABSTRACT
Andean potato weevil Premnotrypes vorax Hustache is a very important potato pest in Colombia, sometimes causing until 100% of damage. The objective of this research was to evaluate native isolates of Beauveria spp. against P. vorax In vitro. Entomopathogenetic isolates were obtained from infected larvae and adults of P. vorax, Tecia solanivora, Phthorimaea operculella, Aepytus sp., Hypotenemus hampei and Rynchophorus palmarum. Five of eigth isolates (Bv01, Bv02, Bv05, Bv07 y Bv08), with mortality higher than 60% and greather conidia production, were selected in vitro.. The efficacy of each isolate was evaluated on 10 P. vorax larvae. Larvae were disinfected, and submerged in a suspension of 1x107espores.mL-1. Mortality was assessed each 48 hour during 16 days. A completely randomized design, with six treatments and four replicates was used. All isolates reached an accumulative mortality of 100%, sixteen days after inoculation.. However, the isolate Bv07 showed the highest entomopatogenic activity against P. vorax In vitro.
Key words: Fungus, larvae, entomopatogenic, mortality, potato crop.
[1] I.A., Joven Investigador Colciencias Grupo Manejo Biológico de Cultivos-GMBC. Universidad Pedagógica y Tecnológica de Colombia-UPTC. Tunja. Colombia. Avenida Central de Norte 39-115 Tunja, Boyacá
[2] *I.A., M.Sc. Entomología. Profesor Titular. Programa de Ingeniería Agronómica. Universidad Pedagógica y Tecnológica de ColombiaUPTC. Tunja. Colombia. Avenida Central de Norte 39-115 Tunja, Boyacá ,Teléfono email:john.martinez@uptc.edu.co
[3] I.A. M.Sc (c). Fisiología vegetal. Universidad Pedagógica y Tecnológica de Colombia, Avenida Central de Norte 39-115 Tunja, Boyacá.
INTRODUCCIÓN
Boyacá y Nariño los mayores productores, con el 80% del área sembrada y de la producción nacional (Alarcón et al. 2011). Esta actividad integra especialmente a pequeños productores quienes derivan de ésta su principal fuente de ingresos, su bienestar y calidad de vida. Dentro de los insectos plaga que afectan este cultivo, se destaca el gusano blanco de la papa (GBP), Premnotrypes vorax Hustache (Coleoptera: Curculionidae) debido a su amplia distribución en las zonas productoras. El daño en el cultivo está relacionado con la pérdida de calidad del tubérculo y el aumento de los costos de producción por el uso de insecticidas de síntesis química que pueden llegar hasta al 100% dependiendo del nivel de infestación y manejo del cultivo (Cotes et al. 2003). La especie se encuentra distribuida en Colombia, Ecuador, Venezuela y Perú (Alcázar y Cisneros 1999). En su estado adulto se alimenta principalmente de las hojas, pero el daño de importancia económica es ocasionado por las larvas, que al alimentarse de los tubérculos hacen galerías afectando la calidad del producto (Niño et al. 2004). Con el fin de disminuir los daños causados por P. vorax, se ha orientado la investigación al estudio de la dinámica poblacional, al empleo de hongos entomopatógenos, barreras vegetales, prácticas culturales y validación del Manejo Integrado de Plagas (MIP) (Cotes et al. 2003; Torres et al. 2004; Bastidas 2005; Zapata et al. 2006; Espitia 2010; Alarcón et al. 2011). Sin embargo, la medida de control más utilizada por los agricultores es el uso de insecticidas químicos como carbamatos, organofosforados y piretroides, que representan un alto porcentaje dentro de los costos directos e incrementan los costos totales de producción del cultivo (Torres et al. 2004). En la mayoría de los casos son aplicados sin tener en cuenta un monitoreo para generar umbrales de afectación económica, y solo se tiene el criterio de proteger la cosecha contra el eventual ataque del insecto, originando problemas de contaminación ambiental, resistencia de la plaga, aumento de plagas secundarias y efectos nocivos para la salud de agricultores y consumidores del tubérculo (Yanggen et al. 2003). Frente a este panorama se genera la necesidad de buscar alternativas de control de la plaga, de bajo impacto ambiental y que tengan una alta eficacia en su control. Una de éstas es el uso de microorganismos entomopatógenos. Entre los géneros más conocidos están Paecilomyces, Hirsutela, Beauveria y Metarhizium (France et al. 1999). Beauveria sp. y Metarhizium sp. han mostrado eficacia insecticida in vitro y en campo sobre P. vorax (Cotes et al. 2003; Mena et al. 2003; Torres et al. 2004; García et al. 2006, Espitia 2010; Guapi 2012), así como también se han encontrado evidencias del control que ejercen estos hongos sobre otro tipo de plagas tropicales (Giraldo 2001; Pariona et al. 2007; Góngora 2008). En la presente investigación se recurrió a aislamientos autóctonos de Beauveria spp. procedentes de diferentes zonas del país. teniendo como base los procesos de selección natural y coevolución del hongo con el insecto, factores que pueden generar en las cepas una mayor especificidad en la infección del insecto (France et al. 1999). Con base en las anteriores consideraciones se evaluó en condiciones In vitro la capacidad patogénica de aislamientos autóctonos de Beauveria sp. sobre el control de P. vorax.
MATERIALES Y MÉTODOS
Ubicación. El presente trabajo se desarrolló en el Laboratorio de control biológico del Grupo de Manejo Biológico de Cultivos (GMBC) del Programa de Ingeniería Agronómica de la Universidad Pedagógica y Tecnológica de Colombia sede Tunja, ubicado a una altura de 2680 msnm y temperatura promedio de 13°C.
Obtención de aislamientos de Beauveria spp.
Se evaluaron aislamientos autóctonos de Beauveria sp. obtenidos de larvas y adultos del Gusano Blanco de la Papa (GBP) (Premmotrypes vorax) (Coleoptera: Curculionidae), polilla guatemalteca (Tecia solanivora) (Lepidóptera: Gelechiidae), polilla de la papa (Phthorimaea operculella) (Lepidóptera: Gelechiidae), barrenador del tallo del curubo (Aepytus sp.) (Lepidoptera: Hepialidae), broca del café (Hypotenemus hampei) (Coleoptera: Scolytinae), y picudo de la palma (Rynchophorus palmarum) (Coleoptera: Curculionidae), con signos de infección en campo por hongos entomopatogenos y procedentes de diferentes sistemas agrícolas de los municipios de Ventaquemada, Soata, Siachoque, Umbita, Coper (Boyacá) y San Gil (Santander).
El material colectado se ubicó en cámaras húmedas, a una temperatura aproximada de 13°C, durante ocho días, al cabo de los cuales se observó el crecimiento micelial en adultos y larvas de los diferentes insectos-plaga colectados en los sistemas agrícolas (González et al. 1993). Posterior a la esporulación se hizo siembra directa del micelio desarrollado sobre el cuerpo del estado insectil infectado en cajas Petri las cuales contenían medio de cultivo Agar Papa Dextrosa (PDA® ASIMEL). El medio se aciduló al 1% con ácido láctico suplementado con antibiótico (i.a. cloranfenicol) para evitar la contaminación bacteriana, las cajas se incubaron a 23°C (Lucero et al. 2004) durante diez días (García et al. 2006). Del borde del crecimiento de la colonia se realizaron repiques en PDA hasta lograr colonias puras de los aislamientos. Para su reconocimiento en las pruebas, a cada uno de los aislamientos se asignó un código compuesto de dos letras seguido de un número.
Colección de larvas de P. vorax para pruebas in vitro. Previo a las pruebas de preselección y evaluación in vitro se hizo colecta directa en campo de larvas de GBP en la finca Santa Helena seleccionada por la presencia de la plaga y por la existencia de monocultivo de papa, ubicada en la vereda Chaine, municipio de Soracá (Boyacá), colectando larvas de P. vorax con peso promedio de 0,030g, las cuales fueron dejadas por 30 días en suelo estéril recolectado de la misma finca para probar que estaban libres de patógenos y alimentadas con trozos de papa hasta el inicio del ensayo.
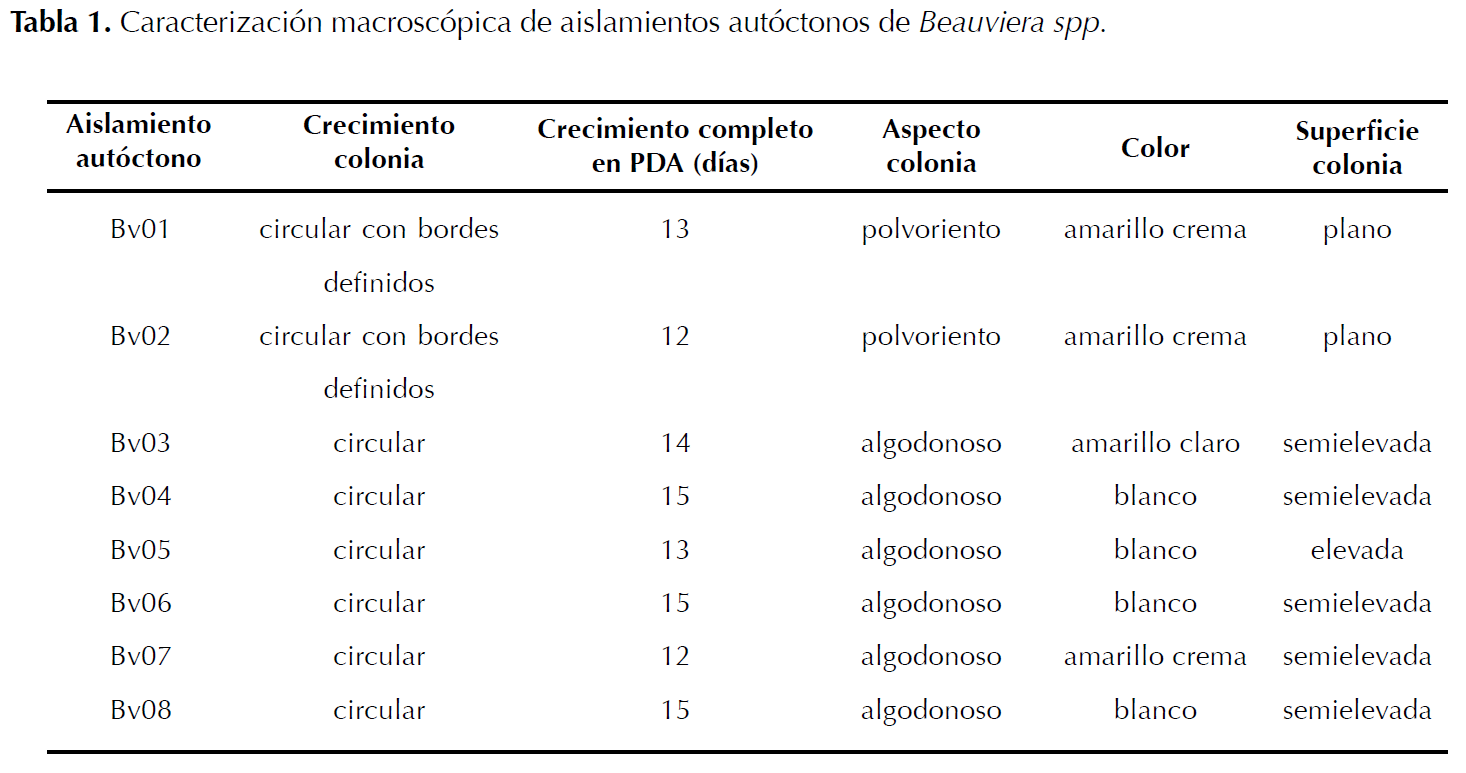
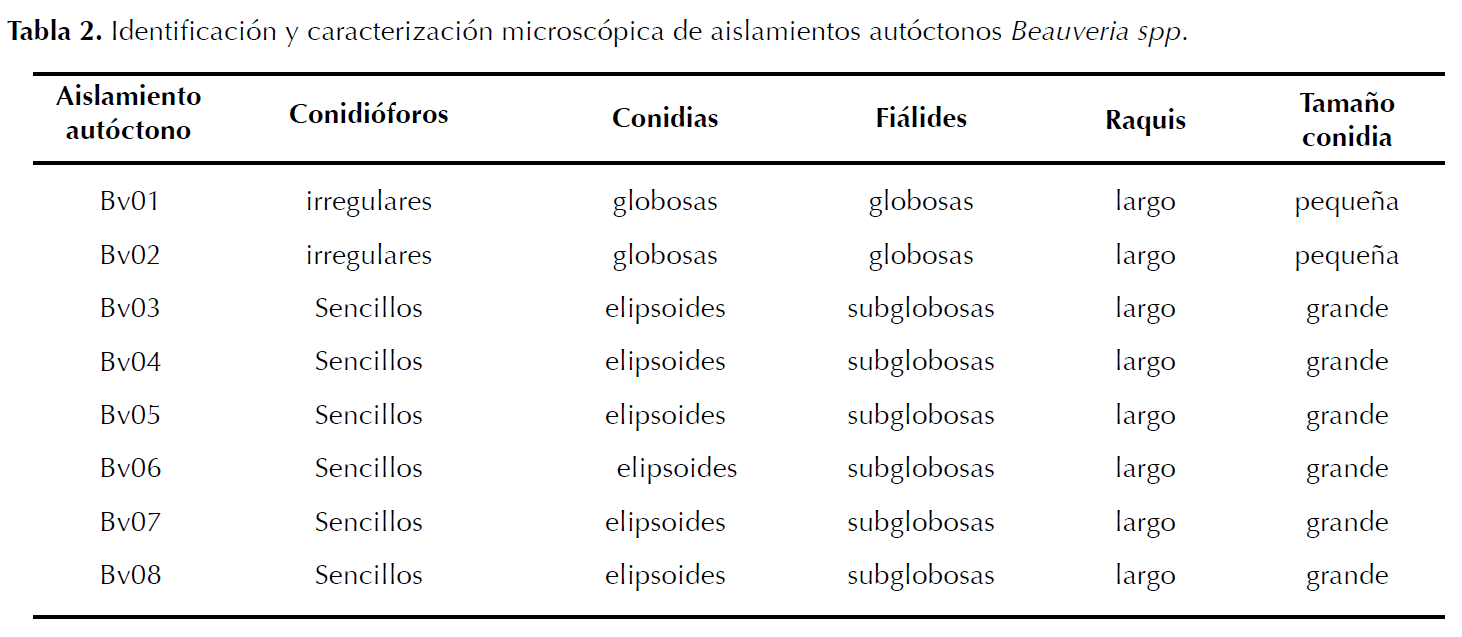
Identificación de aislamientos. Los aislamientos del hongo se sembraron en cajas Petri con medio PDA. Se incubaron a 23 °C por 15 días, durante los cuales se observó el color de las colonias utilizando la tabla Munsell, aspecto, superficie y crecimiento para su identificación (Barnett y Hunter 1998); fueron caracterizados hasta género de acuerdo a características morfológicas descritas por Rehner et al. (2011) (Tabla 1 y 2).
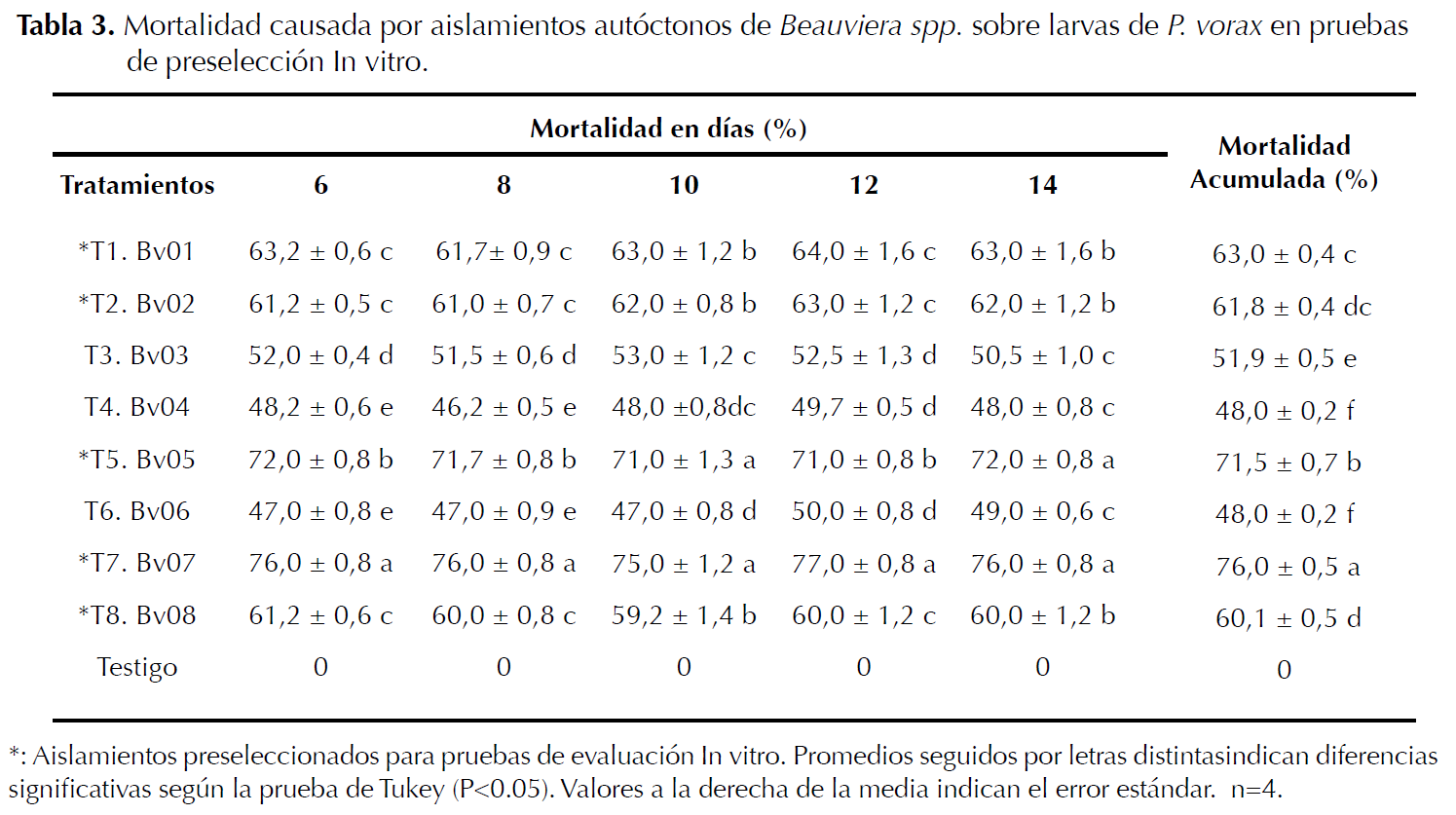
Preselección de aislamientos autóctonos de Beauveria spp. Por la mortalidad sobre larvas de P. vorax, la preselección se hizo mediante evaluación de ocho aislamientos autóctonos de Beauveria sp. Se usó un diseño completamente aleatorio, se evaluaron nueve tratamientos y cuatro repeticiones; los tratamientos estuvieron formados por ocho aislamientos autóctonos de Beauveria sp. (Bv01, Bv02, Bv03, Bv04, Bv05, Bv06, Bv07, Bv08) y un testigo negativo compuesto por larvas de GBP tratadas con agua destilada estéril (A.D.E) (Vélez et al. 1997) (Tabla 3). La población de P. vorax fue constituida por 10 larvas por cada repetición (Mena et al. 2003) para un total de 360 larvas evaluadas. Para realizar el experimento los insectos se desinfectaron con hipoclorito de sodio 0,5% (NaClO 0,5%) durante dos minutos y lavados tres veces con agua destilada para eliminar el exceso del producto desinfectante (Mena et al. 2003).
Obtención de la concentración de conidias. Se preparó una suspensión de cada uno de los aislamientos autóctonos en A.D.E en un patrón de 9 mL, utilizando 1g de PDA colonizado por el entomopatógeno y una alícuota de 10 μL de Tween 80® al 0.1% (ASIMEL), para la dispersión de las conidias (Vélez et al. 1997). De esta suspensión se hicieron diluciones seriadas hasta 1x10-3, tomando de ésta una alícuota de 10μL para hacer los conteos en cámara neubauer con ayuda de un microscopio Nikon®. Para estimar la concentración de esporas se contaron cinco cuadros del cuadrante central de la cámara (Vélez et al. 1997). La densidad de la suspensión de cada uno de los aislamientos fue ajustada a 1x107conidias.mL-1 (Mena et al. 2003).
Inoculación. La inoculación con los aislamientos autóctonos de Beauveria sp., consistió en poner en inmersión 40 larvas de P. vorax por cada aislamiento en una caja Petri (en la cual previamente se colocó una suspensión de 1x107conidias.mL-1), agitando suavemente por dos minutos (Vélez et al. 1997). Al cumplir el tiempo de exposición cada insecto se retiró de forma individual con un pincel (Posada y Vega 2005) e incubó por separado en un vaso plástico semitransparente de 25mL de capacidad previamente esterilizado, y tapa con orificios y el fondo recubierto por 1 cm de suelo estéril + A.D.E a razón de 0,3 mL/vaso. Luego estos fueron dejados a temperatura ambiente, protegidos de la exposición solar directa (García et al. 2006).
Como variables de respuesta se determinó la producción de conidias y la mortalidad de larvas de P. vorax cada 48 horas (Mena et al. 2003), durante 14 días después de la inoculación, utilizando para esto un estereoscopio que permitió discriminar la mortalidad total y la mortalidad causada por el hongo; además, durante las observaciones se adicionaron 0,2 mL de A.D.E a cada uno de los vasos. Por el tiempo del ensayo no se proporcionó alimento para evitar contaminación por hongos (Posada y Vega 2005). De acuerdo con Posada (1998), los insectos pueden sobrevivir por largos períodos de tiempo sin alimento. Terminadas las observaciones se preseleccionaron los mejores aislamientos respecto a la mortalidad de las larvas (Mena et al. 2003) (Tabla 3).
Producción de conidias. De cada una de las cajas Petri de 15 días de desarrollo obtenidas para la identificación de aislamientos, se extrajo cuatro discos de 0,5 cm de diámetro y se mezclaron en 10 mL de Tween 80 al 0,01% estéril. Se contabilizó en cámara de Neubauer el número de conidias (Vélez et al. 1997; Marín y Bustillo 2002) y se prepararon diluciones seriadas hasta 10-3. Para estimar la concentración de esporas se contaron cinco cuadros del cuadrante central de la cámara (Vélez et al. 1997). El ensayo se organizó bajo un diseño experimental completamente aleatorio con cuatro repeticiones por cada uno de los ocho aislamientos autóctonos.
La variable de respuesta fue el número de conidias.mL-1.
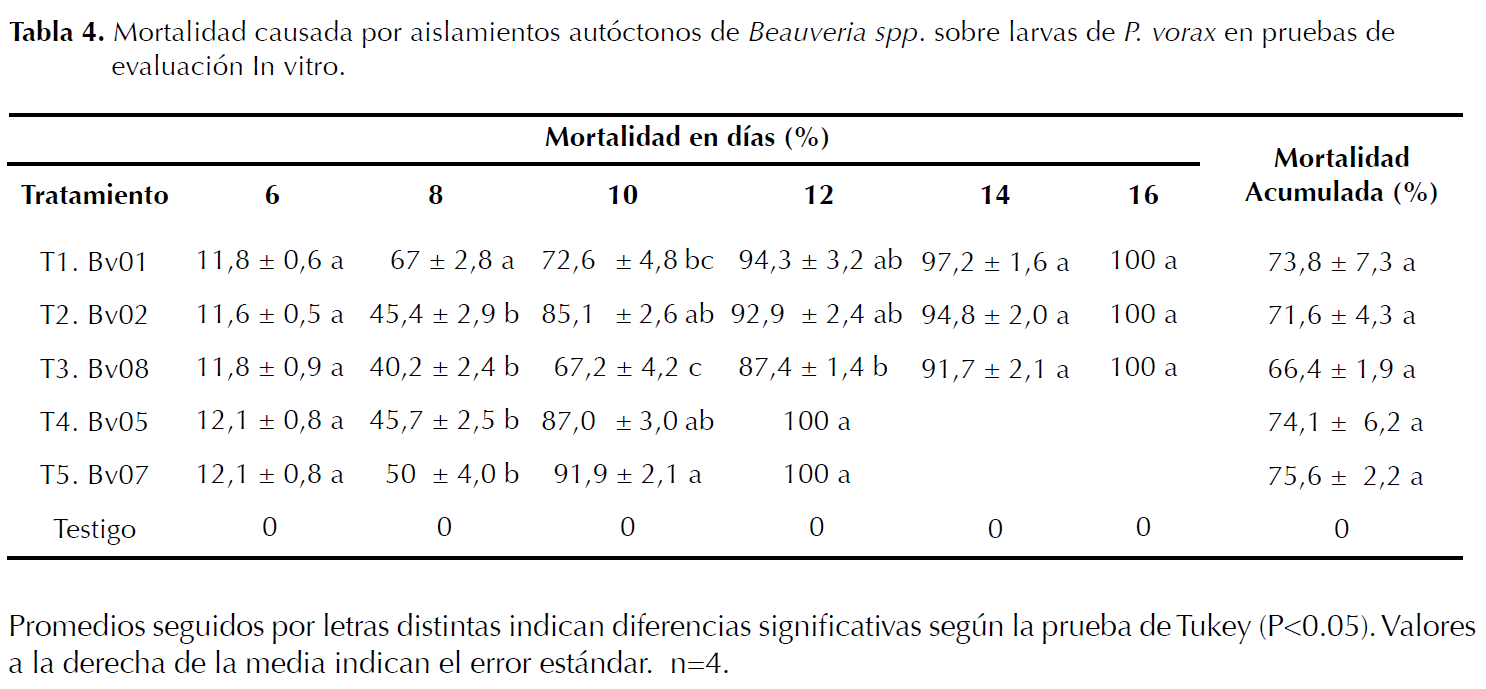
Evaluación de aislamientos preseleccionados de Beauveria spp. por la mortalidad sobre larvas de P. vorax. Las pruebas de patogenicidad en laboratorio se llevaron a cabo utilizando los aislamientos autóctonos de Beauveria spp. Bv01, Bv02, Bv05, Bv07 y Bv08 (Tabla 4), los cuales fueron seleccionados de los ocho aislamientos incluidos en las pruebas de preselección sobre larvas de P. vorax (Tabla 3). Cada aislamiento fue cultivado durante 10 días (García et al. 2006) en 5 cajas Petri con medio PDA acidulado al 1% con ácido láctico suplementado con antibiótico (i.a. cloranfenicol) e incubado a 23°C (Lucero et al. 2004). Se usó un diseño completamente aleatorio, se evaluaron seis tratamientos y cuatro repeticiones; la población de P. vorax fue constituida por 10 larvas por cada repetición (Mena et al. 2003), para un total de 240 larvas evaluadas. El testigo estuvo compuesto por larvas de GBP tratadas con A.D.E (Vélez et al. 1997). La desinfección de los insectos se hizo siguiendo la metodología expuesta anteriormente.
Obtención de la concentración de conidias. Se obtuvo siguiendo la metodología de Vélez et al. (1997), explicada en las pruebas de preselección. La densidad de la suspensión empleada para cada uno de los aislamientos fue de 1x107conidias.mL-1 (Mena et al. 2003).
Inoculación. La inoculación con los cinco aislamientos autóctonos de Beauveria spp., consistió en poner en inmersión 40 larvas de P. vorax por cada aislamiento en una caja Petri (en la cual previamente se colocó una suspensión de 1x107conidias.mL-1), agitando suavemente por dos minutos (Vélez et al. 1997). Al cumplir el tiempo de exposición cada insecto se retiró de forma individual con un pincel (Posada y Vega 2005) e incubó en grupos de a 10 larvas en una caja plástica transparente previamente esterilizada, con orificios por todos sus lados de 0,1cm de diámetro y medidas de 8 cm de ancho x 10 cm de largo y 3 cm de alto, provista de una capa de suelo estéril de 4 cm + A.D.E a razón de 2 mL/vaso. Las cajas fueron dejadas a temperatura ambiente, protegidas de la exposición solar directa (García et al. 2006).
Como variables de respuesta se determinó la producción de conidias y la mortalidad de larvas de P. vorax cada 48 horas (Mena et al. 2003), durante 16 días después de la inoculación, utilizando para esto un estereoscopio que permitió discriminar la mortalidad total y la mortalidad causada por el hongo; además, durante las observaciones se adicionaron 1,5 mL de A.D.E a cada una de las cajas. Por el tiempo del ensayo no se proporcionó alimento a los insectos para evitar contaminación por hongos (Posada y Vega 2005), los cuales pueden sobrevivir por largos períodos de tiempo sin alimentos (Posada 1998).
Producción de conidias. Se siguió el procedimiento utilizado en las pruebas de preselección. El ensayo se organizó bajo un diseño experimental completamente aleatorio con cuatro repeticiones por cada uno de los cinco aislamientos autóctonos. La variable de respuesta fue el número de conidias.mL-1.
Análisis estadístico. Los datos obtenidos fueron sometidos a análisis de normalidad y homogeneidad de varianza para cada variable, mediante la prueba de Shapiro-Will y Levene. Comprobados los supuestos, se realizó análisis de varianza (ANOVA) y test de comparación múltiple de Tukey (P≤0.05) (Gómez y Gómez 1984), utilizando el paquete estadístico SAS v. 9.2e©.
RESULTADOS Y DISCUSIÓN
Identificación de aislamientos. Se caracterizaron morfológicamente ocho aislamientos autóctonos como Beauveria spp. Los aislamientos mostraron colonias inicialmente blancas de aspecto algodonoso y polvoriento que al madurar se tornaron color amarillo claro a crema; superficie plana, elevada a semielevada y crecimiento moderado (Tabla 1). Conidióforos sencillos o agrupados irregularmente y conidios hialinos globosos o elipsoides (Tabla 2). Las características de los aislamientos coinciden con lo descrito por Barnett y Hunter (1998) y Rehner et al. (2011) para Beauveria sp.
Mortalidad. El análisis de varianza indicó diferencias estadísticas entre tratamientos (P≤0.05), al igual que el test de Tukey (P≤0.05).
Se observó que el tratamiento T7 (Bv07) presentó la mayor mortalidad sobre larvas de P. vorax seguido del T5 (Bv05), sin diferencias significativas entre estos para los días 10 y 14, pero si, frente a los demás tratamientos. Los tratamientos T1 (Bv01), T2 (Bv02) y T7 (Bv08) evidenciaron en su orden los mejores porcentajes de mortalidad, sin diferencias durante los 14 días de evaluación. Los aislamientos autóctonos de Beauveria sp. Bv05 y Bv07 causaron mortalidades acumuladas superiores al 70% con diferencias comparativas sobre la población de larvas tratadas de P. vorax 14 días después de la inoculación, seguido de los aislamientos Bv01, Bv02 y Bv08 con 60% sin diferencias estadísticas (Tabla 3).
De los ocho aislamientos autóctonos de Beauveria spp. evaluados, cinco mostraron actividad patogénica sobre la mortalidad de larvas de P. vorax a una concentración de 1x107 esporas.mL-1 (Tabla 3). Lo anterior concuerda con Mena et al. (2003) quienes en pruebas de preselección usaron las mismas concentraciones con aislamientos de B. bassiana sobre larvas de P. vorax alcanzando mortalidades superiores a 50% a los 14 días de evaluación y con Torres y López (1997), al probar en laboratorio aislamientos de Beauveria spp. sobre larvas de P. vorax logrando mortalidades superiores al 70% a los 13 y 15 días de evaluación; lo que sugiere una buena calidad biológica de los aislamientos evaluados en las pruebas de preselección In vitro (González et al. 1993).
Quesada et al. (2007) estudiaron la ocurrencia de M. anisopliae y B. bassiana en diferentes ecosistemas y encontraron una mayor frecuencia en cultivos agrícolas que en hábitat naturales. De acuerdo con esto se puede observar que la patogenicidad está claramente relacionada con las cepas aisladas, ya que no todas poseen la misma capacidad de llevar a cabo su ciclo infeccioso en un mismo hospedero generando diferentes niveles de mortalidad (Kassa et al. 2002).
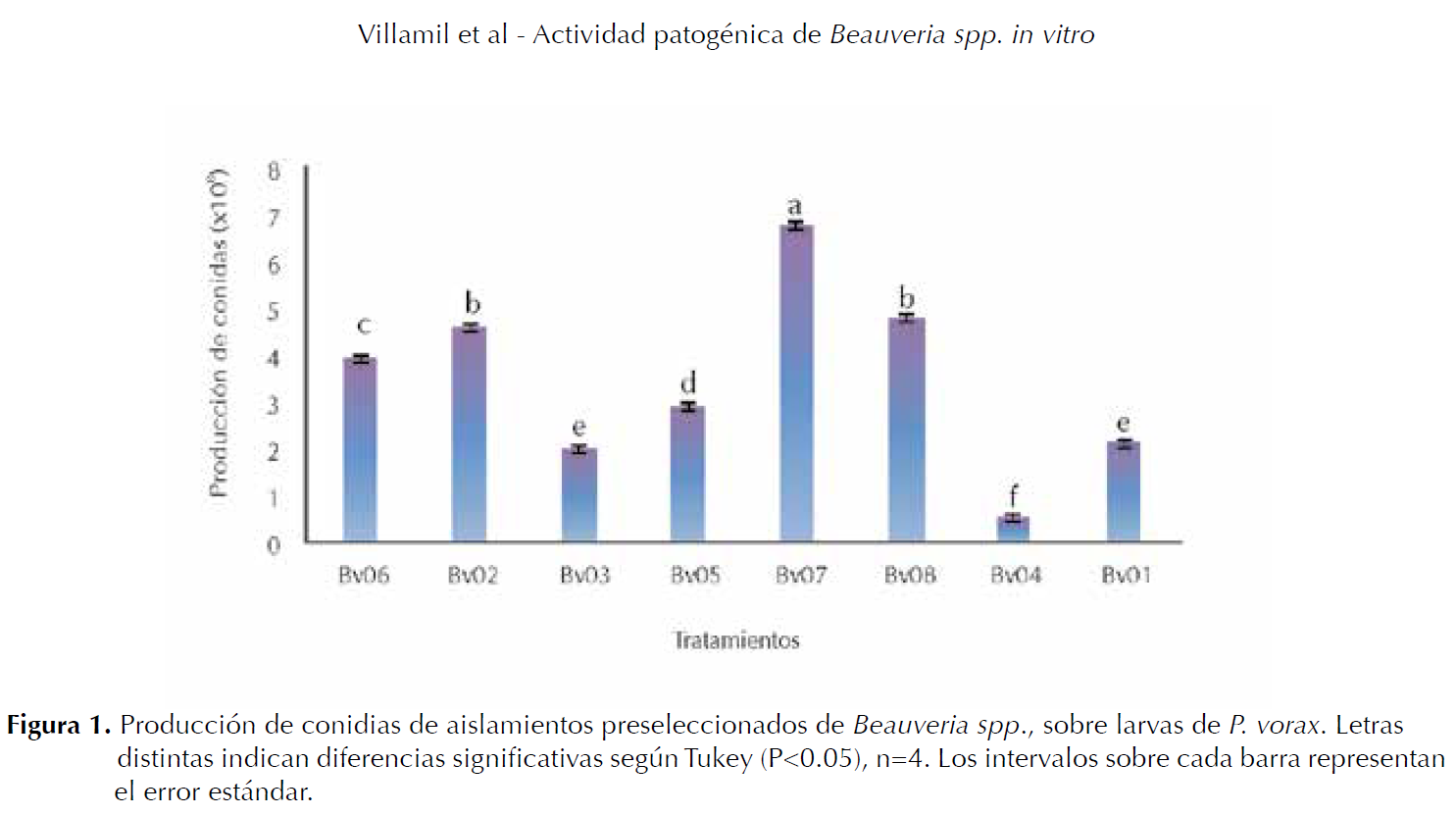
Producción de conidias. El análisis de varianza indicó diferencias significativas (P≤0.05) entre tratamientos, así como la prueba de Tukey (P≤0.05). Los valores de la producción de conidias.mL-1 para cada tratamiento fueron: T1:2.1x108, T2:4.5x108, T3:2x108, T4:0.5x108, T5:2.9x108, T6:3.9x108, T7:6.7x108 y T8:4.7x108. Los valores más altos corresponden a los aislamientos con mayor actividad patogénica sobre larvas de P. vorax.
La figura 1, muestra que los tratamientos T7 (Bv07) y T8 (Bv08) presentaron la mayor producción de conidias con diferencias significativas respecto a los demás tratamientos; mientras que los tratamientos T1 (Bv01), T3 (Bv03) y T4 (Bv04) mostraron la menor producción de conidias, con diferencias estadísticas frente a los demás tratamientos.
De los 5 aislamientos de Beauveria spp. que causaron la mayor mortalidad sobre larvas de P. vorax, cuatro (Bv05 y Bv07, Bv02 y Bv08) se destacaron por la mayor producción de conidias, con una concentración variable de 2,1 a 6,7x108 conidias.mL-1 (Figura 1).
Resultados semejantes han sido demostrados por Mena et al. (2003), con el aislamiento B. bassiana Bb8 evaluado sobre larvas de P. vorax el cual mostró una producción de 7.2x108 conidias.mL-1. Los aislamientos que presentan en ensayos de preselección valores altos en la producción de conidias son candidatos a evaluar en pruebas In vitro para corroborar su potencial entomopatógeno sobre el insecto (Lucero et al. 2004).
Evaluación de aislamientos preseleccionados de Beauveria spp. por la mortalidad sobre larvas de P. vorax.
Mortalidad. El análisis de varianza indicó diferencias significativas entre tratamientos (P≤0.05), al igual que el test de Tukey (P≤0.05) en el día 8, 10 y 12.
La tabla 4, mostró que a partir del día diez los tratamientos T5 (Bv07) y T4 (Bv05), presentaron el mayor porcentaje de mortalidad sobre larvas de P. vorax, provocando la muerte en el día 12 del 100% de la población de larvas tratadas, con diferencias significativas frente al T3 (Bv08). Para el día 16 todos los aislamientos de Beauveria spp. ocasionaron el 100% de mortalidad en las larvas de P. vorax. El T5 presentó la mayor mortalidad acumulada, seguido del T4 sin diferencias comparables respecto a los demás tratamientos.
La tabla 4, mostró que a partir del día diez los tratamientos T5 (Bv07) y T4 (Bv05), presentaron el mayor porcentaje de mortalidad sobre larvas de P. vorax, provocando la muerte en el día 12 del 100% de la población de larvas tratadas, con diferencias significativas frente al T3 (Bv08). Para el día 16 todos los aislamientos de Beauveria spp. ocasionaron el 100% de mortalidad en las larvas de P. vorax. El T5 presentó la mayor mortalidad acumulada, seguido del T4 sin diferencias comparables respecto a los demás tratamientos.
Los aislamientos autóctonos de Beauveria sp. Bv07 y Bv05 evaluados In vitro, presentaron el mejor efecto patogénico sobre larvas de P. vorax 12 días después de la infección (Tabla 4). Resultados similares han sido reportados por Landázuri et al. (2005), donde aislamientos de Beauveria spp. provocaron el 100% de mortalidad de larvas de P. vorax a los 13 días de inoculación. Lo cual coincide con lo reportado por Barriga et al. (2002), quienes registraron mortalidades del 100% sobre adultos de P. vorax 10 días después de la activación de aislamientos autóctonos de Beauveria spp., provenientes de adultos del GBP, colectados en campo y evaluados en grupos de 20 individuos en cajas plásticas usando suelo estéril como sustrato. Las mayores mortalidades acumuladas sobre P. vorax mostradas por los aislamientos Bv07 (75,6%) y Bv05 (74,1%) 16 días después de la inoculación, concuerdan con García et al. (2006) quienes documentaron eficacia entomopatógenica de 96,4% sobre larvas de GBP 18 días después de la activación usando la cepa B. bassiana Bv025. Al respecto Torres et al. (1993) y Barriga (2003), evidenciaron In vitro 65% y 78% de mortalidad sobre adultos de P. vorax 15 días después de activar aislamientos autóctonos de Beauveria sp.
Producción de conidias. El análisis de varianza indicó diferencias significativas (P≤0.05) entre tratamientos, así como la prueba de Tukey (P≤0.05). Los valores de la producción de conidias para los tratamientos fueron: T1:2.3x108, T2:4.8x108, T3:5x108, T4:3.2x108 y T5:7x108. Los valores más altos corresponden a los aislamientos con mayor actividad patogénica sobre larvas de P. vorax.
En la Figura 2, se observa que el tratamiento T5 (Bv07) presentó la mayor producción de conidias con diferencias significativas respecto a los demás tratamientos, seguido del T3 (Bv08) con diferencias frente al T1 (Bv01) y T4 (Bv05).
El T1 mostró la menor producción de conidias, siendo estadísticamente diferente a los demás tratamientos.
El aislamiento de Beauveria sp. Bv07 se destacó por la mayor producción conidial, con una concentración de 7x108 conidias. mL-1 (Figura 2). Estos resultados concuerdan con Guapi (2012), quien evaluó un aislamiento preformulado de B. bassiana sobre larvas y adultos de P. vorax obteniendo una producción media de 7.8x108 conidias. mL-1. De acuerdo con Posada y Vega (2005) la selección de aislamientos con un buen potencial genético en cuanto a producción conidial, es un aspecto básico en la producción a escala comercial de hongos entomopatogenos.
El mayor porcentaje de mortalidad acumulada y la mayor producción de conidias presentes en el aislamiento Beauveria sp. Bv07 aislado de Aepytus sp. (Lepidóptera: Hepialidae), son características deseables en el control de calidad de formulaciones de los hongos entomopatógenos (Vélez et al. 1997). La variabilidad en las características evaluadas demuestra la importancia que tiene la caracterización de aislamientos y manifiestan el potencial del hongo estudiado para pruebas posteriores bajo condiciones de campo (Posada y Vega 2005). Los aislamientos de hongos entomopatógenos que proporcionan una muerte rápida y producen un alto número de esporas pueden desempeñar un papel importante en causar epizootias naturales (Lacey et al. 2001), por lo tanto intervienen en la reducción de las poblaciones de P. vorax y favorecen un sistema agrícola más sostenible.
El efecto patogénico del aislamiento Bv07 podría estar evidenciando, que la infección de Aepytus sp. pudo haber sido eventual, teniendo en cuenta que las larvas o adultos de P. vorax podrían haber estado en contacto con el insecto que también es susceptible en estado larval al ataque de B. bassiana (Joy y Sherin 2013), y haberse contaminado accidentalmente. Aepytus sp. se encuentra en la misma zona agroecológica del GBP en Boyacá, como lo demuestra el aislamiento Bv05 de Ventaquemada aislado de P. vorax con actividad patogénica sobre la mortalidad de larvas de P. vorax (74,1%) en esta investigación. Al respecto, Bolaños et al. (1998), en un estudio realizado en trigo encontraron que diferentes especies de chizas (A. scarabaeoides, Phillophaga sp., Astaena sp.), presentaron infecciones naturales de M. anisopliae y B. bassiana. Estas especies igualmente, están presentes en las mismas zonas agroecológicas de P. vorax en el Departamento de Nariño
Es importante señalar que los hongos entomopatógenos tienen la capacidad de especializarse en su acción patogénica sobre los insectos a los cuales se les aplica el control (Zimmermann 2007), debido a que la virulencia y especificidad de Beauveria sp. varía considerablemente entre aislamientos (Lecuona 1996), por la existencia de diferentes especies (Berreta et al. 1998). Cruz et al. (2006) y Arrubla et al. (2010), registraron la existencia de cepas de B. bassiana con capacidad virulenta sobre H. hampei, obtenidas de diferentes insectos presentes en cultivos colombianos y de otros países; lo cual concuerda con los resultados obtenidos en este estudio.
CONCLUSIÓN
Existen aislamientos regionales de Beauveria sp. en Boyacá que muestran actividad patogénica sobre larvas de P. vorax In vitro.
Se identificaron morfológicamente ocho aislamientos autóctonos de Beauveria spp., obtenidos de larvas y adultos de diferentes insectos-plaga de los cuales cinco mostraron actividad patogénica sobre larvas de P. vorax, sin diferencias significativas respecto a la mortalidad acumulada.
Con base en el mayor porcentaje de mortalidad acumulada y mayor producción de conidias, el aislamiento con el mejor potencial de utilización en el manejo del GBP en las zonas productoras de Boyacá, fue Beauveria sp. Bv07 aislado de un lepidóptero, el cual puede ser evaluado en condiciones de campo para el control de P. vorax.
AGRADECIMIENTOS
Los autores expresan sus agradecimientos a Colciencias, Programa Jóvenes Investigadores e Innovadores 2012 y la Dirección de Investigaciones de la Universidad Pedagógica y Tecnológica de Colombia- UPTC. Así mismo a la Corporación Centro de Innovación del Trópico Alto sostenible- CEI3TAS, por la cofinanciación del proyecto, al profesor Jorge Orlando Blanco Valvuena por su orientación en la metodología, al Ingeniero Agrónomo Raúl Tenza Cardenal por sus valiosos aportes y colaboración, y a todo el equipo de trabajo del Laboratorio de control biológico del GMBC.
REFERENCIAS
Alarcón, J., Arévalo, E., Díaz, A., Galindo, J., Rivero, M. y Tovar, E. 2011. Manejo fitosanitario del cultivo de la papa (Solanum tuberosum subsp. andigena y S. phureja), medidas para la temporada invernal. Produmedios, Bogotá D.C., p 5-16.
Alcázar, J. y Cisneros, F. 1999. Taxonomy and bionomics of the Andean Potato Weevil complex: Premnotrypes spp., and related genera. En: Arthur, C., Ferguson, P. y Smith, B. (Ed). Impact on a changing world. Edition International Potato Center Perú, Lima, p 141-151.
Arrubla, P., Cárdenas, R. y Posada, F. 2010. Efecto de la humedad relativa sobre la germinación de las esporas de Beauveria bassiana y la patogenicidad a la broca del café Hypothenemus hampei. Revista U.D.C.A Actualidad & Divulgación
Científica 13(1):67-76.
Barriga, E., Landázuri, P., Gallegos, P. y Williams, R. 2002. Evaluación en Laboratorio de Patogenicidad de Aislamientos Nativos de Beauveria sp. y Metarhizium anisopliae para Control de Premnotrypes vorax. Revista Latinoamericana de la Papa 13:104111.
Barriga, E. 2003. Evaluación de la patogenicidad y multiplicación en sustratos de aislamientos de Beauveria brogniartii y Metarhizium anisopliae para el control de Premnotrypex vorax en laboratorio y campo. Tesis Ingeniero agrónomo, Universidad central de Ecuador, Quito.
Bolaños, A., Campuzano, L., Arcila, M. y Yepes, D. 1998. Obonuco Obando 98: nueva variedad mejorada de trigo para la zona de modernización del cultivo en el departamento de Nariño, Boletín divulgativo No. 7. Corpoica C.I. Obonuco, Pasto, p 10-20.
Barnett, H. y Hunter, B. 1998. Illustrate general of imperfect fungi. The American Phytopathological Society, Minnesota, p 217.
Berreta, M., Lecuona, R., Zandomeni, R. y Grau, O. 1998. Genotyping isolates of the entomopathigenic fungus Beauveria bassiana by RAPD with fluorescent labels. Invertebrate Pathology 71(2):145-150.
Bastidas, S. 2005. El catzo o adulto del gusano blanco de la papa y alternativas de manejo. Guía de aprendizaje para pequeños agricultores. INIAP, Quito, p 78.
Cotes, A., Zuluaga, M., Espinel, C., Villamizar, L., Torres, L., Gómez, M. y López, J. 2003. Evaluación en campo de un Bioplaguicida a base de Beauveria bassiana para el control biológico del gusano blanco de la papa (Premnotrypes vorax) en la región Cundiboyacense y transferencia de la tecnología a los agricultores. Produmedios, Bogotá D.C., p 10.
Cruz, L., Gaitán, A. y Góngora, C. 2006. Exploiting the genetic diversity of B. bassiana for improving the biological control of the coffee berry borer through the use of strain mixtures. Applied Microbiology and Biotechnology 71(6):918-926.
Espitia, E. 2010. Manejo Integrado de las plagas del cultivo de Papa. Memorias. Simposio Nacional de Actualización en el Cultivo de Papa Solanum tuberosum L. Universidad Pedagógica y Tecnológica de Colombia, Tunja, noviembre de 2010, p 48-108.
France, A., Gerding, A., Sandoval, S., Espinosa, Y. y Vivanco, E. 1999. Patología de Insectos. INIA Quilamapu, Chillán, p 119.
Góngora, C. 2008. Los hongos entomopatógenos en el control de insectos. En: Bustillo, P. (Ed). Los insectos y su manejo en la caficultura Colombiana. Ediciones Cenicafé, Chinchiná, p 133-149.
Giraldo, E. 2001. Actividad lipolítica y proteolítica de Beauveria bassiana y Metarhizium anisopliae y su relación con la patogenicidad sobre Hypotenemus hampei (Coleóptera: Scolytidae). Revista Colombiana de Entomología 27(1-2):6165.
González, M., Posada, F. y Bustillo, A. 1993. Bioensayo para evaluar la patogenicidad de Beauveria bassiana (Bals.) Vuill. Sobre la Broca del Café, Hypothenemus hampei (Ferrari). Revista Colombiana de Entomología 19(4):123-130.
García, M., Villamizar, L., Torres, L. y Cotes, A. 2006. Efecto de subcultivos sucesivos de Beauveria Bassiana sobre su morfología y actividad contra Premnotypes vorax. Manejo Integrado de Plagas y Agroecología de Costa Rica 77:50-57.
Guapi, A. 2012. Evaluación de la eficacia del bioformulado de Beauveria bassiana., y tipos de aplicación para el control del gusano blanco de la papa (Premnotrypes vorax), en dos localidades de la provincia de Chimborazo. Tesis Ingeniero Agrónomo, Escuela Superior Politécnica de Chimborazo, Riobamba.
Joy, P. y Sherin, C. 2013. Insect pests of passion fruit (Passiflora edulis): Hosts, Damage, Natural Enemies and Control. http://www. kau.edu/prsvkm/tripod.com [May 24, 2015].
Kassa, A., Zimmermann, G., Stephan, D. y Vidal, S. 2002. Suceptibility of Sitophilus zea mais (Coleoptera: Curculionidae) Prostephanus truncates (Horn) (Coleoptera: Bostrichidae). Entomopathogenic Fungi from. Biocontrol Science and Technology 12:727–736.
Lucero, A., Peña, L. y Bacca, T. 2004. Evaluación de la actividad biocontroladora de Beauveria bassiana y Metarhizium anisopliae sobre larvas de Ancognatha scarabaeiodes (Coleoptera: Scarabaeidae). Ciencia & Tecnología Agropecuaria 5(1):43-48.
Lacey, L., Frutos, R., Kaya, H. y Vail, P. 2001. Insect pathogens as biological control agents: do they have a future?. Biological Control 21:230-248.
Landázuri, P., Gallegos, P. y Barriga, E. 2005. Control In vitro de Premnotrypes vorax (Hustache) con aislamientos de Beauveria sp. y Metarhizium sp. Serie Zoológica 1:5158.
Lecuona, R. 1996. Microorganismos patógenos empleados en el control microbiano de insectos plagas. Editorial Talleres Gráficos Mariano, Santa Fe, 333 p.
Marín, P. y Bustillo, A. 2002. Pruebas microbiológicas y fisicoquímicas para el control de calidad de los hongos entomopatógenos. Memorias Curso Internacional Teórico-Práctico sobre entomopatógenos, parasitoides y otros enemigos naturales de la broca del café. Cenicafé, Chinchiná, marzo de 2002, p 7289.
Mena, J., Peña, L. y González, R. 2003. CL50 y variación de la patogenicidad en aislamientos de Beauveria bassiana y Metarhizium anisopliae evaluados en poblaciones de Premnotrypes vorax. Innovación & Cambio Tecnológico de Corpoica 4(1):49-54.
Niño, L., Acevedo, E., Becerra, F. y Guerrero, M. 2004. Aspectos de biología y fluctuación poblacional del gusano blanco de la papa Premnotrypes vorax Hustache (Coleoptera: Curculionidae) en Mucuchíes estado de Mérida, Venezuela. Entomotrópica 19(1):15-19.
Posada, F. 1998. Production, formulation and application of Beauveria bassiana for Hypothenemus hampei in Colombia. Ph.D. Thesis, University of London, Canada.
Posada, F. and Vega, F. 2005. A new method to evaluate the biocontrol potential of singles pore isolates of fungal entomopathogens. http:// www.insectscience.org/5.37. [April 20, 2015].
Pariona, N., Castellanos, P. y León, E. 2007. Capacidad entomocida de cepas nativas de Beauveria sp., sobre Schistocerca piceifrons peruviana (Lynch Arribalzaga, 1903). Revista Peruana de Biología 14(2):253-257.
Quesada, E., Navas, J., Maranhao, E., Ortiz, A. y Álvarez, C. 2007. Factors affecting the ocurrence and distribution of entomopathogenic fungi in natural and cultivated soils. Mycological Research 111:947-966.
Rehner, S., Minnis, A., Sung, G., Luangsa-ard, J., Devotto, L. & Humber, R. 2011. Phylogeny and systematics of the anamorphic, entomopathogenic genus Beauveria. Mycologia 103(5):1055-1073.
Torres, R. y López, A. 1997. Estudios básicos sobre el control microbiológico del gusano blanco de la papa (Premnotrypes vorax) con Beauveria sp. y Metarhizium sp. Revista Colombiana de Entomología 23(12):83-88.
Torres, H., Ortega, A., Alcázar, J., Ames, T. y Palomino, L. 1993. Control Biológico del Gorgojo de los Andes (Premnotrypes spp.) con Beauveria brongniartii, Guía técnica. Centro Internacional de la papa, Lima, p 37.
Torres, L., Espinel, C., Villamizar, L., Gómez, M., Zuluaga, M., López, J., Cotes, A. y López, A. 2004. Desarrollo de un insecticida microbiano para el control biológico del gusano blanco de la papa. Produmedios, Bogotá D.C., p 75.
Vélez, P., Posada, F., Marín, P., González, M., Osorio, E. y Bustillo, A. 1997. Técnicas para el control de calidad de formulaciones de hongos entomopatogenos. Boleten Técnico, No. 17, Cenicafé, Chinchiná, p 7-37.
Yanggen, D., Crissman, C. y Espinosa, P. 2003. Los plaguicidas: impactos en producción, salud y medio ambiente en Carchi. Abya Yala, Quito, p 198.
Zimmermann, G. 2007. Review on safety of entomopathogenic fungus Beauveria bassiana and Beauveria brongniartii. Biocontrol Science and Technology 7(5:6):553-596.
Zapata, J., Navas, G., Tamayo, A. y Díaz, C. 2006. Manejo agronómico de la papa criolla para el procesamiento industrial. Boletín Técnico No. 19. Corpoica-La Selva, Produmedios, Rionegro, p 44.