Conservación de la guayaba (Psidium guajava L.) en postcosecha mediante un recubrimiento comestible binario
Conservation of postharvest guava (Psidium
guajava L.) through an edible binary coating
Rafael E. González[1]*, Yoelis C. Cervantes[2], Lorenis del C. Caraballo2
Recibido para publicación: Febrero 23 de 2016 - Aceptado para publicación: Mayo 27 de 2016
RESUMEN
Actualmente la aplicación de recubrimientos comestibles en la industria de los alimentos ha tomado gran importancia, ya que es una tecnología que permite alargar el tiempo de vida útil en frutas y productos mínimamente procesados. En la presente investigación se evaluó el efecto de la aplicación de un recubrimiento comestible a base de concentrado de proteína de suero lácteo (CPSL) y glicerol (GLI) en la conservación de la guayaba “pera” (Psidium guajava L.). La investigación se realizó empleando un diseño factorial 22 donde los factores fueron el CPSL (4 y 2% p/v) y GLI (10 y 14% v/v), mientras que los niveles correspondieron a las respectivas concentraciones de cada factor. Como agente antimicrobiano se utilizó extracto de orégano (Origanum vulgare). Las propiedades fisicoquímicas, sensoriales y microbiológicas fueron evaluadas durante 15 días. Finalmente, con el fin de predecir el tiempo microbiológico de vida útil se empleó la ecuación de Arrhenius. Los resultados indican que es posible incrementar la vida útil de las guayabas hasta 45.9 días aplicando un recubrimiento comestible utilizando CPSL a 4%(p/v) y GLI al 10 %(v/v). La aplicación de los recubrimientos comestibles modificó significativamente la composición fisicoquímica de los frutos examinados, mientras el análisis sensorial mostró que la aceptación general y el color mejoraron su aceptación en comparación con los frutos no recubiertos. Por tanto, es posible que recubrimientos a base de CPSL, GLI y extracto de orégano sean tenidos en cuenta por la industria frutícola para recubrir frutas y aumentar su vida útil.
Palabras clave: Conservación, Extracto de orégano, Guayaba pera, Proteína de suero lácteo, Recubrimiento comestible.
ABSTRACT
Nowadays the application of edible coatings in the food industry has become highly important because it is a technology that can extend the shelf life of fruit and minimally processed products. In this research, the effect of applying an edible coating based on whey protein concentrate (WPC) and glycerol (GLY) on the conservation of guava (Psidium guajava cv) was evaluated. The research employed a factorial design 22 in which the factors were WPC (4 and 2% w/v) and GLY (10 and 14% v/v) and the levels were the concentrations of each factor. Oregano extract (Origanum vulgare) was used as antimicrobial agent. Physicochemical, sensorial and microbiological properties were evaluated during 15 days. Finally, the guava postharvest shelf life was estimated by using Arrhenius equation. The results indicate that it is possible to increase the microbiological shelf life of guava up to 45.9 days using an edible coating based on WPC 4% (w/v) and 10% (v/v) of GLY. Applying edible coatings significantly modified the physicochemical composition of the examined fruits, while the sensory analysis showed that general acceptance and color improved the guava approval compared to uncoated fruits. Therefore, it is likely that coatings based on WPC, GLY and oregano extract could be taken into account by the agricultural industry in order to extend the fruit shelf life.
Key words: Conservation, Oregano extract, Guava pear, Whey protein concentrate, Edible coating
[1] * PhD. Profesor Auxiliar. Grupo IFCRA. Facultad de Ingeniería. Universidad de Cartagena, Piedra de Bolívar - Av Del Consulado, Calle 30 N° 48-157., Cartagena D.T. y C Colombia. Teléfono (6) 6752024, (6)6752040 rgonzalezc1@unicartagena.edu.co
[2] Ingenieras de Alimentos. Facultad de Ingeniería. Universidad de Cartagena. Universidad de Cartagena, Piedra de Bolívar - Av Del Consulado, Calle 30 N° 48-157., Colombia
INTRODUCCIÓN
El consumo de frutas y vegetales disminuye el riesgo de desarrollar enfermedades crónicas como hipertensión, artritis reumatoide, osteoporosis, asma y cataratas debido a su composición nutricional (Boeing et al. 2012). No obstante. Las pérdidas post cosecha ocasionan una disminución en la calidad nutricional de las frutas y vegetales disminuyendo los efectos benéficos mencionados anteriormente (Lin and Zhao 2007).
La guayaba (Psidium guajava L) pertenece a la familia de las Myrtaceae y tiene elevados contenidos de vitamina C. P. guajava L. es un fruto estacional, que se encuentra principalmente en las regiones tropicales y subtropicales del mundo. Los principales países productores del fruto son: Brasil, India, Sur África, México, Colombia, Cuba, Kenia y Taiwán (Hong et al. 2012; Patil et al. 2014). Aunque varios productos se pueden obtener a partir de este fruto, la guayaba es consumida principalmente en fresco y exhibe una elevada velocidad de respiración y una rápida maduración, lo cual conlleva a un rápido deterioro durante el almacenamiento (Hong et al. 2012).
En tal sentido, es de interés evaluar el uso de recubrimientos comestibles (RC) para mejorar la calidad de la guayaba durante su almacenamiento. Un RC se puede definir como una matriz continua, delgada, que se estructura alrededor de una matriz alimentaria mediante la inmersión de la matriz en una solución formadora del recubrimiento (Quintero et al. 2010). Los recubrimientos y las películas comestibles se han empleado durante siglos principalmente para prevenir la pérdida de humedad y mantener la calidad y textura de diversos sistemas alimentarios durante el almacenamiento (Jooyandeh 2011).
Los RC aplicados sobre frutas y vegetales controlan la transferencia de humedad, procesos de oxidación y aumentan la vida útil (Veiga et al. 2005; González et al. 2015). Igualmente los RC pueden proporcionar el mismo efecto que las atmósferas modificadas. Adicionalmente, ingredientes activos pueden ser incorporados a los RC y consumidos junto con el alimento reforzando así la seguridad y calidad nutricional del fruto (Dhall 2013).
A través de los años, varios estudios han sido desarrollados con el fin de incrementar la vida útil de matrices alimentarias mediante la aplicación de RC (Elsabee and Abdou 2014; Falguera et al. 2011) como papayas (Brasil et al. 2012; Ali et al. 2011), manzanas (Chiumarelli and Hubinger 2014), fresas (Gol et al. 2013) y guayabas (Hong et al. 2012; Bezerra et al. 2015). Las investigaciones concernientes a guayabas se han enfocado principalmente en estudiar la textura, el análisis fisicoquímico y microbiológico (Bezerra et al. 2015; Zambrano et al. 2013), sin considerar la vida útil microbiológica mediante la aplicación de modelos predictivos. Hasta el momento no hay casi información concerniente a la utilización de un concentrado de proteína de suero lácteo en la estimación de la vida útil microbiológica de guayabas mediante modelos matemáticos. Por tanto, el objetivo de la presente investigación fue evaluar el efecto de un recubrimiento comestible a base de CPSL y glicerol en la conservación post cosecha de la guayaba pera (Psidium guajava L.) durante su almacenamiento a 30 °C.
MATERIALES Y MÉTODOS
Recolección de la Muestra. Los frutos de P. guajava L. fueron seleccionados teniendo en cuenta el desarrollo fisiológico y el índice de madurez, además que fueran frutos sanos, de buena calidad y tamaño homogéneo.
Obtención del extracto acuoso. Las plantas de Orégano (Origanum vulgare) fueron lavadas con agua destilada e hiploclorito de sodio a 200 ppm durante 5 min y enjuagadas con abundante agua destilada. Las hojas fueron secadas al aire a temperatura ambiente y finalmente el material fue triturado en una proporción 1:3 (agua destilada: hojas). La solución resultante fue filtrada separando la porción acuosa de la vegetal en dos etapas, en la primera etapa se utilizó algodón como medio filtrante y en la segunda etapa se utilizaron filtros de hemicelulosa siguiendo la metodología propuesta por Herrera y García (2006). El extracto final fue almacenado en refrigeración en frascos color ámbar hasta su posterior uso.
Elaboración del Recubrimiento Comestible. Se utilizó un diseño factorial 22 donde los factores fueron el concentrado de proteína de suero lácteo (4 y 2 % p/v) y glicerol (10 y 14% v/v), mientras que los niveles fueron las respectivas concentraciones de cada factor. Las CPSL fueron disueltas en agua destilada con ayuda de una plancha de calentamiento bajo agitación constante, una vez disuelta la solución se incorporaron las concentraciones indicadas de GLI. La solución resultante fue sometida a calentamiento 90 °C / 10 minutos en baño de maría, subsiguientemente, la temperatura se disminuyó hasta alcanzar 30 °C con el fin de adicionar el extracto acuoso de orégano.
Aplicación de recubrimiento en las Guayabas pera (Psidium guajava L). Las guayabas fueron previamente lavadas y sanitizadas en agua clorada (100 ppm de cloro) durante 5 min antes de ser recubiertas. La aplicación del recubrimiento en los frutos se realizó por inmersión durante 60 s. Posteriormente, los frutos se llevaron a almacenamiento durante 15 días a 30 °C y una humedad relativa controlada.
Análisis fisicoquímicos. Los valores de pH fueron determinados utilizando un pH metro (Thomson Bante). 5 g de cada fruta fueron homogeneizados con 45 mL de agua destilada y el homogeneizado fue empleado para la determinación del pH. La acidez titulable fue determinada conforme al método descrito por Bassetto et al. (2005) con modificaciones. Un gramo del fruto fue homogeneizado en 30 mL de agua destilada, la titulación se llevó a cabo con 0,1 N de NaOH y se expresa como porcentaje de ácido cítrico. La humedad fue determinada mediante secado de las muestras en crisoles en horno a 105 °C durante 24 h mediante diferencia de pesos iniciales y finales. El contenido de sólidos solubles totales (SST) fue determinado con un refractómetro (Fischer, Extech Model 2132, Rumania) y los resultados fueron expresados como °Brix. Todas las mediciones fisicoquímicas fueron tomadas de dos guayabas a 30 °C por 15 días.
Análisis microbiológico. Se tomaron 11 g de guayabas recubiertas y sin recubrir (control) y se adicionaron en 99 mL de agua de peptona, subsiguientemente se realizaron diluciones seriadas consecutivas y finalmente se determinó la concentración bacteriana de aerobios mesófilos, hongos y levaduras, coliformes totales y fecales por el método de recuento en placa y número más probable respectivamente.
Análisis sensorial. El panel conformado por 30 jueces no entrenados evaluaron las muestras codificadas. La evaluación sensorial (color, sabor, aroma y aceptabilidad global) se basó en la escala hedónica de 10 puntos (1, me disgusta extremadamente; 10 me gusta extremadamente). Las muestras fueron presentadas en contenedores plásticos libres de olores, se utilizó agua para el lavado de la boca entre muestras y tres muestras fueron presentadas a cada panelista.
Predicción de la vida útil microbiológica de la Guayaba Pera (Psidium guajava L). Las guayabas utilizadas en esta investigación fueron divididas en dos lotes. El primer lote fue recubierto con las biopelículas activas, mientras que el segundo fue tomado como muestras control (sin adición de biopelículas). Varias cinéticas de acidez fueron llevadas a por cinética. Los datos obtenidos fueron cabo a cada grupo de guayabas. Las cinéticas se modelados matemáticamente utilizando la realizaron a tres temperaturas diferentes (17, 27 ecuación de Baranyi and Roberts (1994) (Ecu 1) y 37 °C) tomando 15 puntos aproximadamente por medio del programa de computo DMFit 2.0
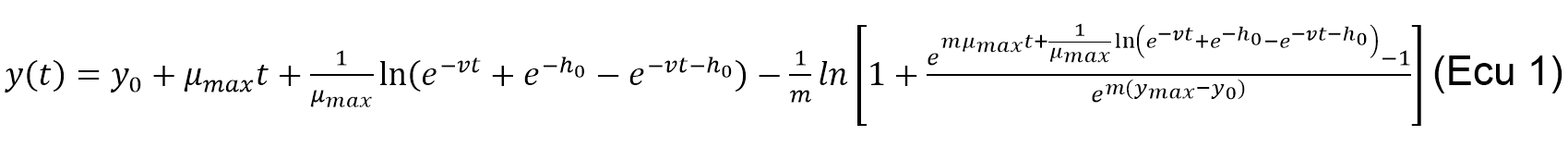
Donde y(t) es la concentración celular o el diámetro de las colonias, y0 es la concentración o diámetro inicial, μmáx es la velocidad específica de crecimiento (1 h), m es un parámetro de curvatura para caracterizar la transición de la fase exponencial, ν es un parámetro de curvatura para caracterizar la transición a la fase exponencial y ho es un parámetro adimensional que cuantifica el estado fisiológico inicial de las células. Una vez obtenidos los parámetros cinéticos, se procedió a estimar la vida útil microbiológica utilizando la ecuación de Arrhenius (Ecu 2).
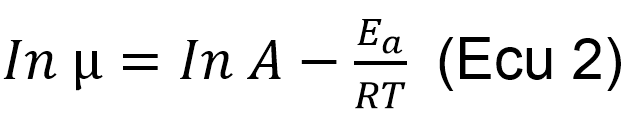
Donde, k es la velocidad de reacción; A es un factor pre-exponencial (intercepto en una gráfica de Lnµ vs 1/T), R es la constante de los gases ideales (8.314 KJ/KgºK), T es la temperatura absoluta (ºK), y Ea es la energía de activación de la reacción límite de velocidadcrecimiento (Ross and McMeekin 1994).
Análisis estadístico. Todos los datos fueron analizados por análisis normal de varianza (ANOVA-un factor) utilizando el programa de computo SPSS (versión 17 para Windows) y las diferencias entre los promedios a un nivel de significancia de 5% fue desarrollada por medio de la prueba de tukey.
RESULTADOS Y DISCUSIÓN
Acidez titulable (AT). El ácido cítrico es el mayor ácido orgánico en la guayaba madura, debido que los ácidos orgánicos contenidos en el fruto verde se van transformado o degradando (Seymour et al. 1993). La AT en las guayabas recubiertas y sin recubrir disminuyó durante todo el almacenamiento y fue afectada significativamente (P<0,05) por las diferentes concentraciones de CPSL y GLI. Similar comportamiento fue reportado por Hong et al. (2012) quienes observaron que los valores de AT en guayabas son directamente proporcionales a las concentraciones de quitosan utilizadas como recubrimiento. Por el contrario, Miranda et al. (2014) reportaron que papayas completas recubiertas con almidón de yuca y cera comercial inicialmente mantienen la acidez y posteriormente comienzan a aumentar de forma significativa en el tiempo, como consecuencia de la disminución de la volatilización de ácidos orgánicos por acción del recubrimiento, permitiendo que los frutos permanezcan más ácidos y verdes.
Las muestras de guayaba sin recubrimiento presentaron un porcentaje de acidez de 0,40% al inicio del almacenamiento (día 1) y al finalizar este periodo (día 15) la AT disminuyó significativamente (P<0,05) hasta alcanzar valores de 0,19%, los cuales son significativamente menores a los encontrados en las muestras de guayaba recubiertas utilizando diferentes concentraciones de CPSL y GLI (Figura 1).
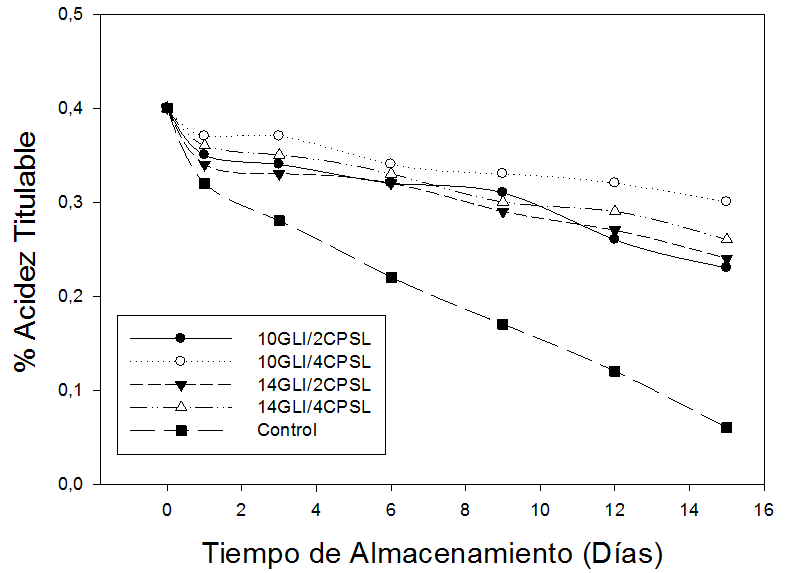
Figura 1. Acidez titulable (AT) de frutas de guayaba (P. guajava L.), sometidas durante 15 días a diferentes concentraciones de concentrado de proteína de suero lácteo (CPSL) y glicerol (GLI).
Una rápida reducción de la acidez da lugar a una rápida senescencia del fruto, en tal sentido, las muestras de guayaba recubiertas con 4% (p/v) de CPSL y 10% (v/v) de GLI que mostraron los valores más elevados de AT (0,30%) a los 15 días de almacenamiento pueden retrasar efectivamente la maduración del fruto, ya que presentaron diferencias significativas (P<0,05) respecto al resto de frutas recubiertas con las distintas combinaciones de CPSL y GLI. Estos resultados concuerdan con los expresados Han et al. (2004) quienes manifestaron que las fresas y frambuesas recubiertas con quitosan retardan el proceso de maduración como consecuencia del efecto barrera ejercido por el recubrimiento, sin olvidar la mencionada disminución de la volatilización de ácidos orgánicos.
Determinación de pH. En la figura 2 se puede apreciar que el pH evidenció un constante aumento durante el almacenamiento de las guayabas recubiertas, corroborando así los resultados obtenidos en la AT. Los ácidos orgánicos disminuyen porque son utilizados como sustrato durante la respiración del fruto (Cantillo 2009). El aumento de pH es también debido a la reducción de la actividad metabólica, la disminución de esta actividad es provocada por la menor difusión del oxígeno, asimismo ocurre con el incremento en la síntesis del contenido de aminoácidos (Miranda et al. 2014).
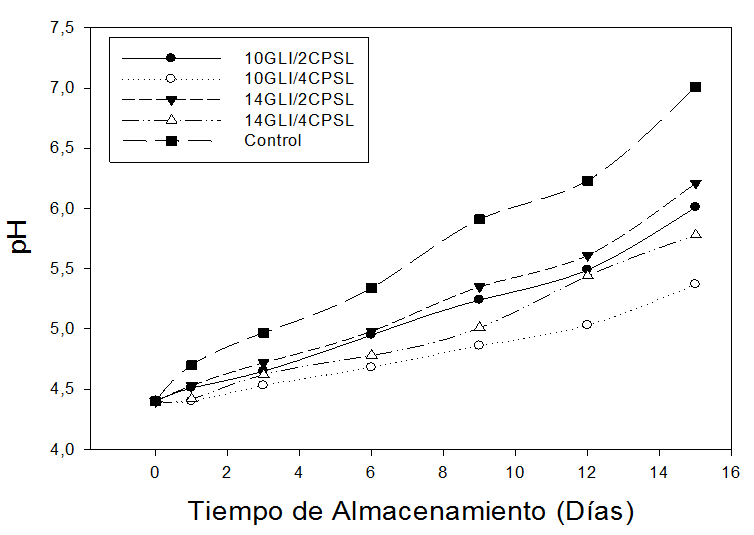
Figura 2. Valores de pH de frutas de guayaba (P. guajava L.), sometidas durante 15 días a diferentes concentraciones de concentrado de proteína de suero lácteo (CPSL) y glicerol (GLI).
El pH varía de acuerdo a los componentes que se encuentran formando el recubrimiento comestible (Han and Gennadios 2005). En el presente estudio se puede demostrar que durante el periodo de almacenamiento, el pH muestra un aumento independiente de las concentraciones de GLI y CPSL utilizados. Saks and Barkai (1995) mencionan que un aumento en los valores del pH durante el almacenamiento conlleva rápidamente a la senescencia del producto.
La tendencia de los valores de pH de los frutos recubiertos se puede atribuir al efecto barrera del recubrimiento comestible, el cual se caracteriza por disminuir el metabolismo activo de la fruta, retardando así la maduración al disminuir la tasa de respiración celular de los tejidos vegetales limitando la degradación de los ácidos orgánicos por la limitada variación del pH (González et al. 2010).
Sólidos solubles totales (SST). El contenido de SST de la guayaba pera (P. guajava L) van aumentando conforme transcurren los días de almacenamiento (Figura 3), similar comportamiento fue obtenido por Miranda et al. (2014) en papayas recubiertas con almidón de yuca al 4% (p/v), este resultado obedece a las reacciones enzimáticas, la translocación de azúcares y la degradación de pectinas durante el proceso de maduración de las frutas de guayaba (Azzolini et al. 2004; Barco et al. 2011).
El contenido de SST en las guayabas sin recubrimiento (control) incrementa significativamente (P<0,05), mientras que las muestras recubiertas experimentan un menor incremento durante los 15 días de almacenamiento. Igualmente, se puede apreciar que el menor incremento (0,3 °Brix) se encontró en la muestra recubierta con 4% (p/v) de CPSL y 10 % (v/v) de GLI, seguida por la muestra recubierta con 4% (p/v) de CPSL y 14% (v/v) GLI, mientras que el mayor incremento se observó en las guayabas sin recubrimiento que alcanzó 5,0 °Brix al final del proceso de conservación (15 días).
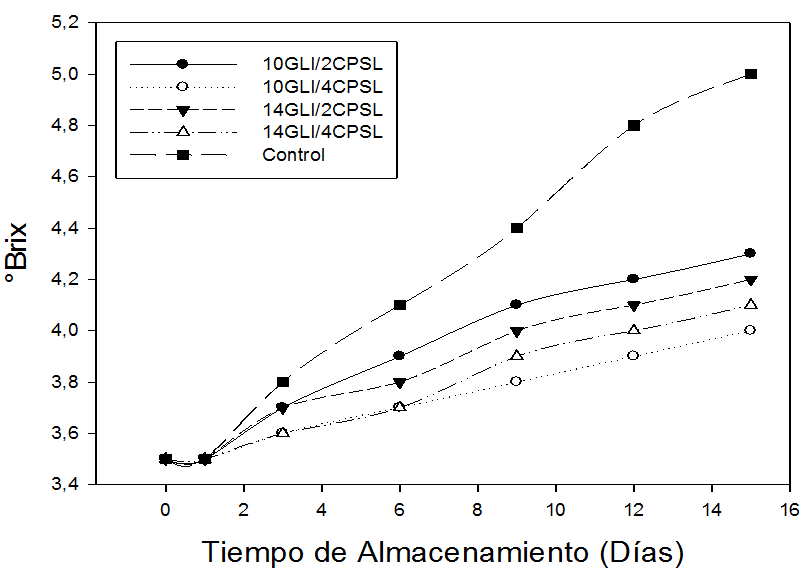
Figura 3. Sólidos totales solubles (SST) de frutas de guayaba (P. guajava L.), sometidas durante 15 días a diferentes concentraciones de concentrado de proteína de suero lácteo (CPSL) y glicerol (GLI).
El efecto de los recubrimientos sobre SST de frutas de guayaba probablemente se debe a la disminución de la respiración y actividad metabólica que retardan el proceso de maduración. Está bien documentado que las propiedades de los recubrimientos ocasionan una barrera semipermeable alrededor de frutas y vegetales modificando la atmósfera interna al reducir el O2 y/o elevar el contenido de CO2 suprimiendo la evolución de etileno (Dong et al. 2004). La disminución de la velocidad de respiración también disminuye la síntesis y uso de metabolitos debido a la reducción de la hidrólisis de carbohidratos a azúcares (Rohani et al. 1997). Los resultados obtenidos en la presente investigación concuerdan con aquellos publicados por Kittur et al. (2001) y Ali et al. (2011) quienes reportaron un leve aumento en el contenido de sólidos solubles en frutas (mango, banana y papaya) recubiertas con películas de quitosan.
Pérdida de peso. La figura 4 indica que la aplicación de los recubrimientos en las guayabas reduce la pérdida de peso en comparación a las guayabas control. Igualmente, se puede apreciar
que las pérdidas de peso se incrementan respecto al tiempo de almacenamiento, debido al proceso de transpiración que presentan los frutos durante este periodo (Azzolini et al. 2004). Generalmente, las menores pérdidas de peso (0,92 – 4,31%) fueron encontradas cuando el recubrimiento contenía 4% (p/v) de CPSL y 10% (v/v) de GLI, seguido por el recubrimiento con 4% (p/v) de CPSL y 14% (v/v) de GLI con pérdidas entre 0,92 y 4,76%. Mientras que las mayores pérdidas fueron reportadas por las guayabas control con valores de pérdidas entre 0,92 y 6,48%, seguido por las guayabas recubiertas con 2% (p/v) de CPSL y 14% (v/v) de GLI, mostrando diferencias significativas (P<0,05) en los porcentajes promedio obtenidos durante el almacenamiento; indicando que el CPSL tiene un mayor efecto control sobre pérdida de peso que el contenido de GLI.
La pérdida de peso en frutas y vegetales se debe principalmente a la pérdida de agua causada por la transpiración y la respiración (Zhu et al. 2008). El CPSL forma una capa semitransparente y continua sobre la superficie de matrices alimentarias, y puede ser utilizada como una barrera para reducir la respiración y las velocidades de transpiración. Los resultados obtenidos en el presente trabajo, indican claramente que los recubrimientos con CPSL y GLI le confieren una barrera física a la pérdida de humedad de la fruta. Por consiguiente, se observó una menor pérdida de peso en las frutas recubiertas. Estos resultados concuerdan con los publicados por Hong et al. (2012) quienes reportaron una marcada disminución en la pérdida de humedad en guayabas recubiertas con quitosan durante 12 días a 11 °C.
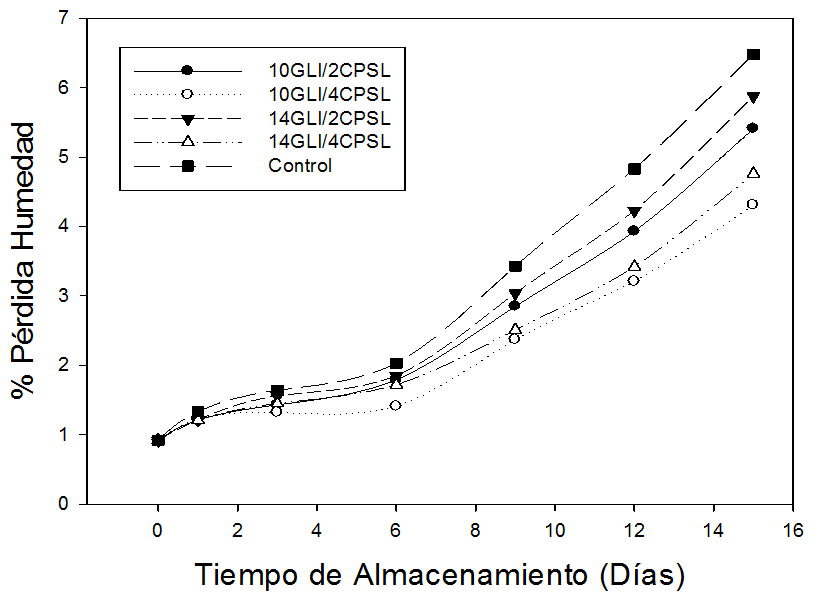
Figura 4. Humedad de frutas de guayaba (P. guajava L.), sometidas durante 15 días a diferentes concentraciones de concentrado de proteína de suero lácteo (CPSL) y glicerol (GLI).
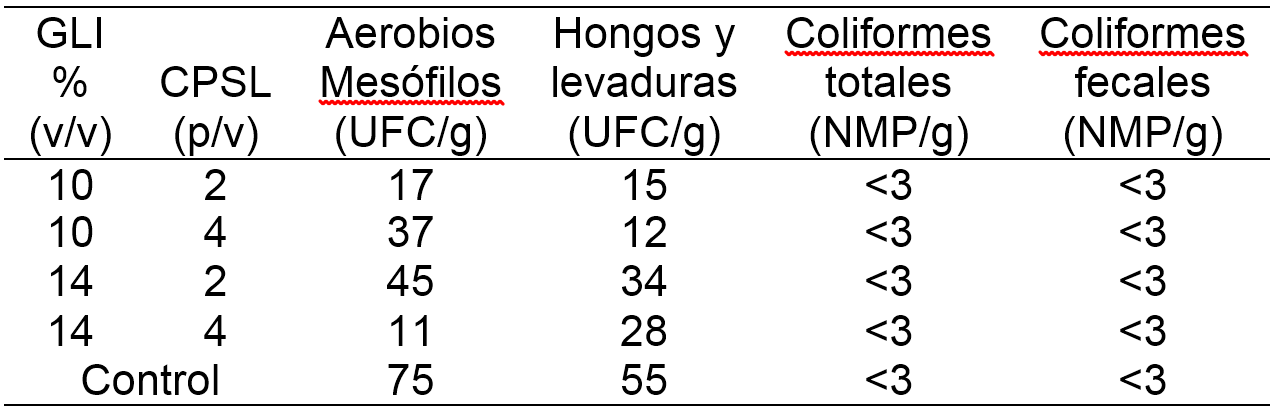
Análisis microbiológicos. En la tabla 1 se presentan los resultados de los análisis microbiológicos llevados a cabo en P. guajava L. con y sin recubrimiento comestible a base de CPSL y GLI. Se puede apreciar que los recubrimientos comestibles elaborados no incorporan microbiota externa a las frutas; siendo esto de gran importancia para la estimación de la vida útil microbiológica. Es importante mencionar que las guayabas con recubrimiento mostraron menores valores de bacterias aerobias mesófilas en comparación a las guayabas control, debido al posible efecto antimicrobiano ejercido por el extracto de orégano. Appendini y Hotchkiss (2002), mencionan que los recubrimientos, además de actuar como barrera de gases, pueden servir para mejorar la seguridad de los alimentos mediante la inhibición o retraso del crecimiento de microorganismos, dando paso al concepto de envasado inteligente.
Tabla 1. Análisis microbiológico de guayabas sin y con recubrimiento comestible a base de concentrado de proteina de suero lacteo CPSL y glicerol GLI.
Determinación de vida útil microbiológica. A partir de las gráficas obtenidas previo modelado de los datos de acidificación a diferentes temperaturas utilizando la ecuación de Baranyi and Roberts (1994) (datos no mostrados) se extraen parámetros cinéticos. Dado que el modelo de Arrhenius es empleado para evaluar el efecto de la temperatura sobre el crecimiento microbiano, k se transforma en la velocidad de crecimiento específico (µ) (Ross and McMeekin 1994; Giannuzzi et al. 1998). La μ para cada temperatura corresponde al valor de la pendiente de la recta de la fase logarítmica. Las constantes del modelo Arrhenius se obtienen de la gráfica Inµ vs 1/T a partir de la ecuación de la recta (Y=mx+b); donde x equivale al valor de la temperatura (4 °C) a la cual se predice la vida útil microbiológica.
Los valores obtenidos en la estimación de la vida útil microbiológica se muestran en la tabla 2, en donde se puede observar un mayor tiempo de vida útil (45,9 días) en la guayaba recubierta con 4% (p/v) de CPSL y 10% (v/v) de GLI, seguida por las combinaciones de 4% (p/v) de CPSL y 14% (v/v) de GLI con 44,8 días, mientras que las guayabas control presentaron el menor tiempo de vida útil microbiológica con 33,1 días. Es importante destacar que el aumento en la vida útil de las guayabas no solamente es ocasionado por el mencionado control de la respiración y actividad metabólica (Dong et al. 2004), también es de considerar el posible efecto antimicrobiano ejercido por el extracto de orégano, el cual limita el crecimiento de bacterias en la superficie de la matriz alimentaria.
Tabla 2. Valores de estimación de la vida útil de guayabas recubiertas y sin recubrir con concentrado de proteina de suero lacteo CPSL y glicerol GLI.

Análisis sensorial. Las pruebas sensoriales fueron llevadas a cabo al finalizar el tiempo de almacenamiento (15 días) a las muestras recubiertas con 4% de CPSL (% p/v) y 10% (v/v) de GLI, ya que en estas muestras se observó el mayor tiempo de vida útil. Los promedios de los puntajes obtenidos por todos los panelistas se presentan en la figura 5. Las muestras de guayaba recubiertas presentaron atributos sensoriales con una puntuación más alta en comparación con las muestras de guayaba sin recubrir.
Es interesante mencionar, que tanto el aroma como el sabor no presentaron diferencias significativas (P<0,05) entre guayabas recubiertas y sin recubrir. Por tanto, se infiere que el CPSL y el GLI no aportan sabores y aromas al fruto. Estos resultados son contrarios a los publicados por Albizú y Ac Pangán en (2011) quienes mencionan que la proteína de suero de leche tiene un sabor que puede ser ligeramente percibido por el consumidor. Con respecto al color, se presentaron diferencias significativas (P<0,05) entre las guayabas recubiertas y sin recubrir, por lo cual se concluye que este atributo afecta en mayor magnitud la aceptación general del fruto en comparación al sabor y aroma. Por lo mencionado anteriormente, es posible utilizar un recubrimiento comestible a base de CPSL (4% p/v) y GLI (10% v/v) con el fin de incrementar la apreciación sensorial de la guayaba.
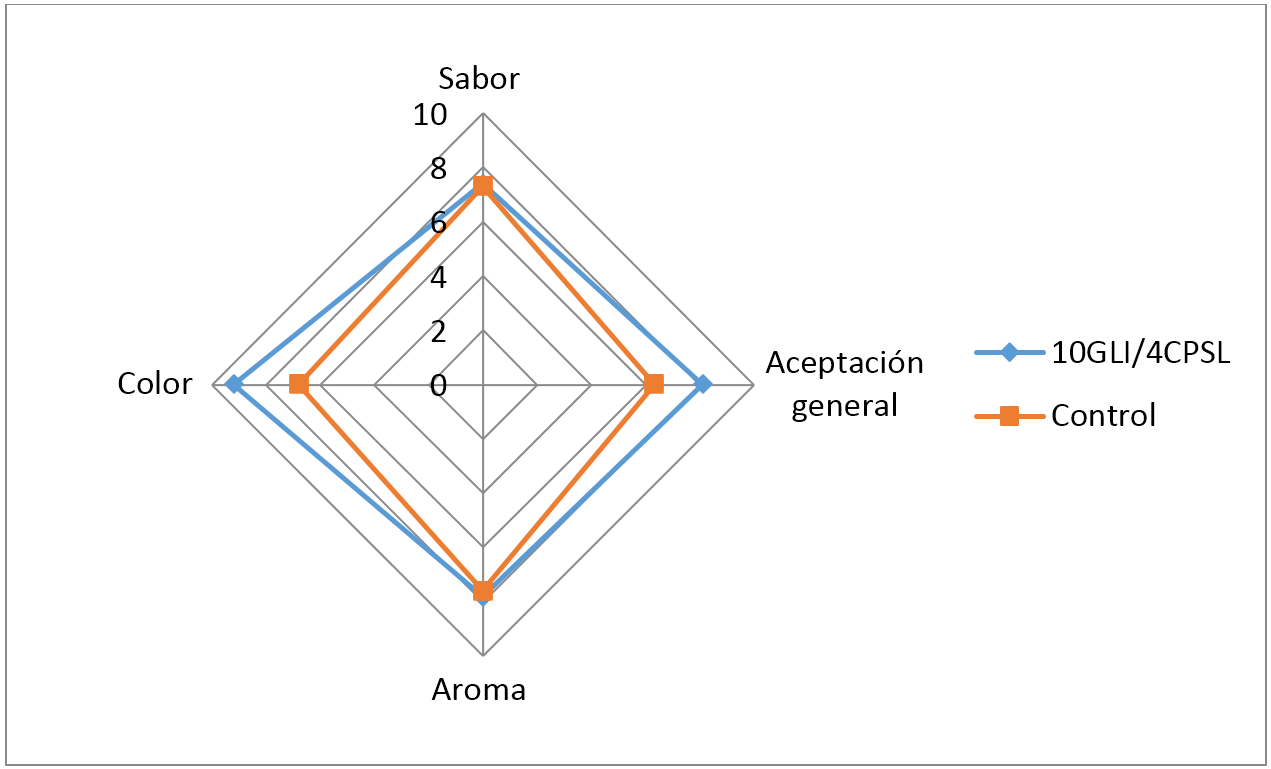
Figura 5. Valores promedio del análisis sensorial de guayabas recubiertas con concentrado de proteina de suero lacteo CPSL y glicerol GLI y muestra control.
CONCLUSIÓN
Los estudios llevados a cabo en este trabajo indican que es posible la aplicación de un recubrimiento a base de CPSL especialmente a 4% (p/v) y 10% (v/v) de GLI para retrasar el proceso de maduración de las guayabas manteniendo la calidad de las frutas. Estas mismas concentraciones de CPSL y GLI incrementan la vida útil microbiológica de las frutas hasta un máximo de 45,9 días. El análisis sensorial muestra que la aceptación general y el color mejoraron su aceptación en comparación con los frutos no recubiertos. Además, la aplicación de los recubrimientos comestibles modificó significativamente la composición fisicoquímica de los frutos examinados. Por tanto, es posible que recubrimientos a base de CPSL, GLI y extracto de orégano sean considerados por la industria hortofrutícola para recubrir frutas y prolongar su vida útil. Estos resultados sugieren que el CPSL y GLI tienen un efecto positivo manteniendo la integridad de las membranas retrasando así el proceso de maduración de la guayaba a través del control de los procesos fisicoquímicos.
REFERENCIAS
Albizú, H. y Ac Pangán, M. 2011.
Desarrollo de un recubrimiento comestible a base de
proteína de suero de leche para queso Cheddar, Proyecto especial de graduación
del programa de Ingeniería en Agroindustria Alimentaria, Escuela Agrícola
Panamericana, Zamorano. Honduras.2.
Appendini, P. and Hotchkiss, J.
2002. Review of
antimicrobial food packaging. Innovative Food Science and Emmerging
Technologies 3:113-126.
Azzolini, M., Jacomino, P., y Urbano, I. 2004.
Indices para avaliar qualidade póscolheita de goibas em diferentes estádios de maturacao. Pesquisa Agropecuaria Brasileira 39(2): 139-145.
Ali, A.,
Muhammad, M., Sijam, K. and Siddiqui, Y. 2011. Effect of chitosan coatings on the
physicochemical characteristics of Eksotika II papaya (Carica papaya L.) fruit during cold storage. Food Chemistry 124,
620–626.
Baranyi, J. and Roberts, T. 1994. A dynamic approach to predicting
bacterial growth in food. International Journal Food Microbiology
23(3-4):277-94.
Bassetto, E., Jacomino, A.,
Pinheiro, A. and Kluge, R. 2005. Delay of ripening of ‘Pedro Sato’ guava with 1-methylcyclopropene. Postharvest
Biology Technology 35, 303– 308.
Barco, P., Burbano, A., Mosquera, S., Villada, H. y Navia, P. 2011.
Efecto del recubrimiento a base de almidón de yuca modificado sobre la maduración del tomate. Revista Lasallista de Investigación 8(2): 96-103.
Bezerra, A.,
Fitzgerald, B. and Lins, S. 2015. Impact of edible chitosan–cassava starch coatings enriched with Lippia
gracilis Schauer genotype mixtures on the shelf life of guavas (Psidium guajava L.) during storage at
room temperature. Food Chemistry 171, 108–116.
Boeing, H., Bechthold, A., Bub, A., Ellinger, S., Haller,
D., Kroke, A., and Stehle, P. 2012. Critical review: vegetables and fruit in the prevention of chronic diseases. European Journal of Nutrition 51(6):637-663.
Brasil, M., Gomes, C., Puerta, A., Castell, E. y Moreira, R. 2012.
Polysaccharide-based multilayered antimicrobial edible coating enhances quality of fresh-cut papaya. LWTFood Science and Technology 47, 39-45.
Cantillo J. 2009.
Caracterización de la respiración, producción de etileno y compuestos volátiles durante el proceso de maduración de cuatro variedades de guayaba Psidium guajava (Myrtaceae) del Departamento de Santander, Colombia. Universidad Nacional de Colombia. Bogotá.
Chiumarelli, M. and Hubinger, M. 2014.
Evaluation
of edible films and coatings formulated with cassava starch, glycerol, carnauba
wax and stearic acid. Food Hydrocolloids 38, 20–27.
Dhall, R. 2013.
Advances in edible coatings for
fresh fruits and vegetables: a review. Critical Reviews in Food Science and
Nutrition 53(5): 435-450.
Dong, H., Cheng, L., Tan, J., Zheng,
K., Jiang, Y. 2004.
Effect of chitosan coating on quality and shelf-life of peeled litchi fruit.
Journal Food Engineering 64, 355–358. Elsabee, M. and Abdou, E. 2014. Chitosan based edible films and
coatings: a review. Materials Science and Engineering C: Materials for
Biological Applications 33(4): 1819-1841. Falguera, V., Quintero, J., Jimenez,
A., Munoz, J. A., and Ibarz, A. 2011.Edible films and coatings: Structures, active
functions and trends in their use. Trends in Food Science and Technology 22,
292–303. Gol, N., Patel, P., and Rao, T.
2013. Improvement of quality and shelf-life of strawberries with edible coatings enriched with chitosan. Postharvest Biology and Technology 85, 185–195. González, R., Castro, J., y Caro Y. 2015. Obtención de
Biopelículas Binarias Activas y su Efecto en la Vida Útil Microbiológica del
Camarón Blanco (Penaeus vannamei).
Información Tecnológica. 26(5): 3-10. González, G.,
Ayala, J., Olivas, G. y Álvarez, E. 2010. Preserving quality of frescut products using
safe technologies. Journal für Verbraucherschutz und Lebensmittelsicherheit
5(1): 65-72. Giannuzzi, L., Pinotti, A., and
Zaritzky, N. 1998.
Mathematical modelling of microbial growth in packaged refrigerated beef stored
at different temperatures. International Journal Food Microbiology 39, 101–110. Han, J. and Gennadios, A. 2005. Edible films and coatings: a
review. En: Innovations in Food Packaging. Editado por J. Han. Elsevier Science
and Technology Books. Han, C., Zhao, Y., Leonard, S.,
Traber, and M., 2004. Edible coatings to improve storability and enhance nutritional value of fresh
and frozen strawberries (Fragaria ananassa) and raspberries (Rubus idaeus). Herrera, F. y
R. García. 2006. Evaluación in vitro del efecto bactericida de extracto
acuso de laurel, clavo, canela, y tomillo sobre cinco cepas bacterianas
patógenas de origen alimentario. Revista Bistua,
4 (2): 13-19. Hong, K., Xie, J., Zhang, L., Sun,
D. and Gong, D. 2012.
Effects of chitosan coating on postharvest life and quality of guava (Psidium guajava L.) fruit during cold
storage. Scientia Horticulturae 144, 172– 178. Jooyandeh, H. 2011. Whey protein films and coatings: A
review. Pakistan Journal of Nutrition 10(3): 296-301. Kittur, F., Saroja, N. and
Habibunnisa R. 2001.
Polysaccharide based composite coating formulations for shelf-life extension of
fresh banana and mango. European Food Research and Technolology 213, 306–311.
Lin, D., and Zhao, Y. 2007.
Innovations in the development and application of edible coatings for fresh and minimally processed fruits and vegetables. Comprehensive Reviews in Food Science and Food Safety 6, 60-75.
Miranda, A., Alvis, A. y Arrazola, G. 2014.
efectos de dos recubrimientos sobre la
calidad de la papaya (carica papaya)
variedad tainung. Temas
Agrarios 19(1):7 – 18.
Patil, V., Chauhan, A. y Singh, R. 2014.
Optimization of the spray-drying process for developing guava powder using response surface methodology. Powder Technology 253, 230–236.
Pérez, B., Vásquez, V., Osuna, G., Padilla, R., Sánchez, L. y
Ruiz, C. 2009. Establecimiento de módulos de validación de cultivares de guayaba (Psidium guajava) bajo condiciones de Nayarit. Segundo y tercer informe parcial periodo: mayo-octubre. Ed. INIFAP. p.3.
Quintero, C., Falguera, V. y Muñoz, A. 2010.
Películas y recubrimientos comestibles:
Importancia y tendencias recientes en la cadena hortofrutícola. Revista Tumbaga 1(5):93-118.
Rohani, M., Zaipun, M. and Norhayati, M. 1997.
Effect of modified atmosphere on the storage life and quality of Eksotika
papaya. J. Trop. Agric. Food Sci. 25, 103–113.
Ross, T. and McMeekin, T. 1994. Predictive microbiology, Review
paper. International Journal Food Microbiology 23, 241 – 264. Saks, Y. and Barkai, R. 1995. Aloe Vera gel activity against
plant pathogenic fungi. Postharvest
Biology and Technology. 6, 159 – 165. Seymour, G., Taylor, G. 1993. Biochemistry of fruit ripening.
Chapman and Hall, Tucker (eds). London. Veiga, P., Oliveira, L. M., Cereda,
M., Alves, A. and Scamparini, A. 2005.Mechanical properties, hydrophilicity and
water activity of starch-gum films: Effect of additives and deacetylated
xanthan gum. Food Hydrocolloids 19, 341-349. Zhu, X., Wang, Q., Cao, J. and
Jiang, W. 2008.
Effects of chitosan coating on postharvest quality of mango (Mangifera indica
L.CV. Tainong) fruits. J. Food Process. Preserv. 32, 770–784. Zambrano, M.,
Mercado, E., Ramirez, P., Cornejo, M., Gutiérrez, E. and Quintanar, D. 2013.
Use of solid lipid
nanoparticles (SLNs) in edible coatings to increase guava (Psidium guajava L.) shelf-life. Food Research International
51, 946–953.