Efecto de cepas del género Enterobacter sp. y Trichoderma koningiopsis en el rendimiento de Lactuca sativa Var L. crispa L.
Effect of strains of the genus Enterobacter sp. Trichoderma koningiopsis in yield of Lactuca sativa Var L. crispa L.
Jeniffer N. Otálora[1], Diana B. Sánchez[2]*, Julio R. Galindo[3]
Recibido para publicación: Agosto 31 de 2015 - Aceptado para publicación: Abril 21 de 2016
RESUMEN
La lechuga (Lactuca sativa L. Var L. crispa L.) es de las hortalizas más cultivadas en el municipio de Mosquera, Cundinamarca, Colombia. En esta investigación se evaluaron dos productos biológicos (Enterobacter sp., TVL-1 y TVL-2) con capacidad de suplir las necesidades de fosforo de la planta y un producto biológico (Trichoderma koningiopsis TH003) con capacidad de controlar Sclerotinia sp., estos se compararon con los métodos tradicionales de fertilización y control químico (Fungicida a base del ingrediente activo procimidona), el diseño estadístico fue 14 tratamientos, evaluados en un ensayo bajo el diseño de bloques completos al azar, con tres repeticiones. La adición de las bacterias mejoró el crecimiento de las plantas, sin que se demostrara diferencia por efecto de los Enterobacter TVL-1 y TVL-2. El efecto de aplicar las Enterobacter sp., es mayor cuando se aplican solas, que cuando se aplican acompañadas de T. koningiopsis TH003. Es decir, cuando se observan los tratamientos sin T. koningiopsis TH003, el peso fresco aéreo aumentó en un 32,3% (0,15 g/planta) con la aplicación de Enterobacter sp., en semillero; en campo el aumento del peso fresco aéreo fue de 16,9% respecto al testigo sin Enterobacter sp. El tratamiento con el producto biológico Trichoderma koningiopsis TH003, presentó incidencia de Sclerotinia sp., inferior al 0,35% y una severidad inferior al 15%; el testigo absoluto con fertilización presentó incidencia de 10,71% y una severidad del 30%, por lo que se concluye que Trichoderma koningiopsis TH003 tiene un buen control de las enfermedades que se presentan en el cultivo.
Palabras clave: Hortalizas, Fertilización, Fungicida, Severidad, Incidencia.
ABSTRACT
Lettuce (Lactuca sativa L. Var L. crispa L.) is one of the most cultivated vegetables in the town of Mosquera, Cundinamarca Colombia. In this research two biological products (Enterobacter sp., TVL-1 and TVL-2) were evaluated with the capacity to supply the needs of phosphorus plant and a biological product (Trichoderma koningiopsis TH003) with the ability to control Sclerotinia sp., these were compared with traditional methods of fertilization and chemical control (fungicide procymidone the active ingredient), the statistical design was 14 treatments, which were evaluated in a trial under the design of randomized complete block design with three replications. Adding bacteria improved plant growth, with no differences were shown by effect of Enterobacter TVL-1 y TVL-2. The effect of applying the Enterobacter sp., is greater when applied alone, which when applied accompanied by T. koningiopsis TH003. That is, when treatments without koningiopsis TH003 T. observed, air fresh weight increased by 32.3% (0.15 g / plant) with the application of Enterobacter sp in seedbed; in field increasing air fresh weight was 16.9% compared to the control without Enterobacter sp. Treatment with Trichoderma koningiopsis biological product TH003, provided an incidence of Sclerotinia sp, less than 0,35% and less severity than 15%; the absolute control with fertilization presented incidence of 10.71% and a severity of 30%, so it is concluded that Trichoderma koningiopsis TH003 has good control of diseases that occur in culture.
Key words: vegetables, fertilization, fungicide, severity, impact.
[1] Ingeniero Ambiental. Universidad De Cundinamarca. jenifffer11@hotmail.com
[2] * M.Sc. Investigador Máster, C.I. Turipaná, Corporación Colombiana de Investigación Agropecuaria – CORPOICA. Km 13 vía Montería – Cereté (Colombia), Teléfono +57(1) 7691057 Ext 2249. Autor de correspondencia: dbsanchez@corpoica.org.co
[3] Ph.D en Fisiología Vegetal, Investigador Ph.D, Centro de Investigación Tibaitatá. Corporación Colombiana de Investigación Agropecuaria – Corpoica. Mosquera (Colombia). jgalindo@corpoica.org.co
INTRODUCCIÓN
En el departamento de Cundinamarca, la producción hortícola, representa uno de los porcentajes más altos a nivel nacional en el año 2013 tuvo una participación del 56% con respecto al total nacional, seguido de Nariño con 24,9%, Antioquia con 15%, Valle del Cauca con 1,4% y Norte de Santander con 1,3% (Cámara de comercio de Bogotá 2015). Sin embargo, las zonas planas de la sabana de Bogotá son propensas a problemas de drenaje y acumulación de sales, que obligan a un manejo adecuado de la fertilización y a la reducción de fuentes químicas de nutrientes. Además, el uso intensivo de plaguicidas se convierte en un riesgo de contaminación tanto del producto como de las fuentes de agua, de por sí ya deterioradas por tratarse de aguas residuales en su mayor parte (Universidad Nacional de Colombia 2009); por lo anterior, resulta conveniente reducir las aplicaciones de plaguicidas y utilizar productos biológicos más amigables con el ambiente (FAO 2012).
Teniendo en cuenta lo anteriormente expuesto, es necesario emplear opciones que permitan reducir la aplicación de productos de síntesis química en la producción de lechuga, más aún por ser el cultivo agrícola principal de la zona. Una variante al uso de productos químicos, es el empleo de productos biológicos como biofertilizantes y biofungicidas, como estrategia viable para el agricultor y amigable con el medio ambiente. Por tanto, el objetivo de esta investigación fue evaluar el efecto de dos microorganismos solubilizadores de fosfatos del género Enterobacter sp., con potencial como biofertilizante, y el efecto de Trichoderma koningiopsis TH003como biocontrolador de enfermedades fungosas, en la producción de un cultivo de Lactuca sativa en la vereda San José, del municipio de Mosquera, Cundinamarca.
MATERIALES Y MÉTODOS
Área y microorganismos
El ensayo se llevó a cabo el Centro de Investigación Tibaitatá, en las instalaciones de CORPOICA, km 14 vía Bogotá – Mosquera. Entre los meses de agosto y diciembre de 2011. Como biofertilizantes, se evaluaron dos bacterias solubilizadoras de fosfato del género Enterobacter sp. TVL-1 y TVL-2 (Sánchez et al. 2011), como biocontrolador, se empleó la cepa del hongo Trichoderma koningiopsis TH003 suministradas por los laboratorios del Centro de Investigación Biotecnología y Bioindustria (CBB)-Corpoica.
Evaluación en semillero bajo cubierta
Para la evaluación en semillero, se utilizó semilla de lechuga tipo Batavia (Lactuca sativa Var L. crispa L.) El establecimiento de las plántulas se realizó en siete bandejas de 200 alvéolos, las cuales fueron desinfectadas con una solución de hipoclorito de sodio al 2,0%. Posteriormente se llenaron con turba humedecida y se colocaron tres semillas por alveolo. La inoculación de los microorganismos, E.TVL1 y E.TVL2 (1 x 108UFC/ml) y TH003 (1 x 109 conidios/ml) se realizó a los siete días después de la siembra; se inoculó directamente el suelo de cada planta con 1 mL de la suspensión bacteriana medio Luria Bertani. El diseño usado en semillero vario con el implementado en campo, en semillero se usó solo 7 tratamientos y no hubo variación en el uso de fertilizante, el objetivo fue llevar las plántulas con los inóculos ya establecidos. Los tratamientos usados fueron T1: E.TVL1, T2: TH003, T3: Testigo absoluto, T4: E.TVL2, T5: E.TVL1+TH003, T6: E.TVL2+TH003 y T7: Testigo químico. El diseño experimental fue completamente aleatorio, con cinco repeticiones por tratamiento. Al cabo de un mes, se realizó muestreo destructivo, que consistió en tomar 5 plántulas por tratamiento para evaluar variables de crecimiento, las plántulas restantes fueron llevadas a campo para continuar con el ensayo; estos tratamientos fueron sembrados bajo condiciones de cubierta plástica en el C.I. Tibaitatá. Las variables de crecimiento tomadas fueron: altura de la planta (cm), longitud radical (cm), número de hojas, peso seco de la parte aérea (g) y raíz, peso fresco parte aérea y raíz (g) y área foliar (cm2) medida con laser CID Bio– science ®, CI202..
Ensayo en campo de lechuga tipo Batavia.
Para realizar el ensayo en campo se eligió un lote del C.I. Tibaitatá de 5,8 ha que estaba destinado a la siembra comercial de lechuga, para lo cual se preparó con arado de disco y cincel, demarcando dos camas en un lugar central. Luego, sobre el terreno seleccionado se delimitaron 42 unidades experimentales de 3,6 m2 cada una, con 28 plantas por unidad. Se asignaron los tratamientos a las unidades siguiendo el diseño experimental de bloques completos al azar, con arreglo factorial 7x2, en tres repeticiones (7 Tratamientos x 2 niveles de fertilización). El factor de siete niveles correspondió al manejo biológico del suelo, y el factor de dos niveles correspondió al manejo de fósforo en el suelo con o sin la aplicación de fosfato diamónico; en dichos tratamientos se evalúo la acción de los fungicidas químico y biológico, combinados con el potencial biofertilizante de las dos cepas bacterianas; el orden y la distribución en campo: de acuerdo al esquema a.

Posteriormente al trasplante, se efectúo una nueva aplicación del biofertilizante (Igual a la dosis inicial) y se adicionó el biofungicida WP a base de TH003 (Se repitió el empleo del biofungicida a los 7, 21, 28 y 42 días, con una dosis de 1 G L-1. La aplicación de procimidona se realizó a la dosis comercial. Para el manejo de arvenses se cubrieron las camas con una capa de 15 cm de pasto seco “mulch”, salvando de cubrir las plantas de lechuga; este mulch también contribuyó a conservar la humedad del suelo.
Durante el desarrollo fenológico de las plantas de lechuga no se requirió riego en ningún momento, debido a la periodicidad de las lluvias durante los meses de septiembre a noviembre. Una semana después de establecer el cultivo, se realizó la fertilización según las recomendaciones técnicas, la adición de fósforo solo se realizó a los 25 días del cultivo en campo y en una sola cama. A la mitad del desarrollo del cultivo se efectuó una segunda fertilización con urea, nitrato de magnesio y cloruro de potasio a las dosis recomendadas según el análisis de suelos.
El muestreo destructivo se realizó después de 90 días, y las variables de crecimiento analizadas fueron: altura de la planta (cm), longitud radical (cm), área foliar (cm2), peso seco y fresco de la parte aérea y radical (g).
Enfermedades del cultivo de lechuga tipo Batavia.
Durante el desarrollo de la planta se midió la severidad e incidencia de enfermedades en el cultivo. La severidad de ataque de Sclerotinia sp., se evaluó empleando la escala visual de 5 grados como se describe a continuación: 0 = planta sana; 1 = <25% del área foliar afectada; 2 = <50% del área foliar afectada; 3 = <75% del área foliar afectada; 4 = <100% del área foliar afectada y 5 = planta muerta (Craft y Nelson 1996; Osorio et al. 2005). Considerando que la unidad de superficie fue de 3,6 m², y la densidad de población fue 28 plantar por U.E.
Análisis estadístico.
Los datos fueron sometidos al análisis de varianza con el software SAS 9.4. En el artículo se presentan las estimaciones de la diferencia de promedios de tratamientos, el error estándar de la diferencia y la prueba de t asociada, que evalúa la hipótesis nula a un nivel de significancia del 5,0%. La comparación de promedios incluyó la agrupación de tratamientos de acuerdo con la estructura factorial de los mismos, para evaluar el efecto de los productos biológicos respecto a los químicos, la interacción de los diferentes productos, y los efectos simples cuando ocurrió una interacción significativa.
RESULTADOS Y DISCUSIÓN
Porcentaje de germinación de semillas De las 7 bandejas, el porcentaje de germinación fue de 72,14%, con un coeficiente de variación referente a la media de 22,37%. En esta etapa aún no se habían aplicado tratamientos.
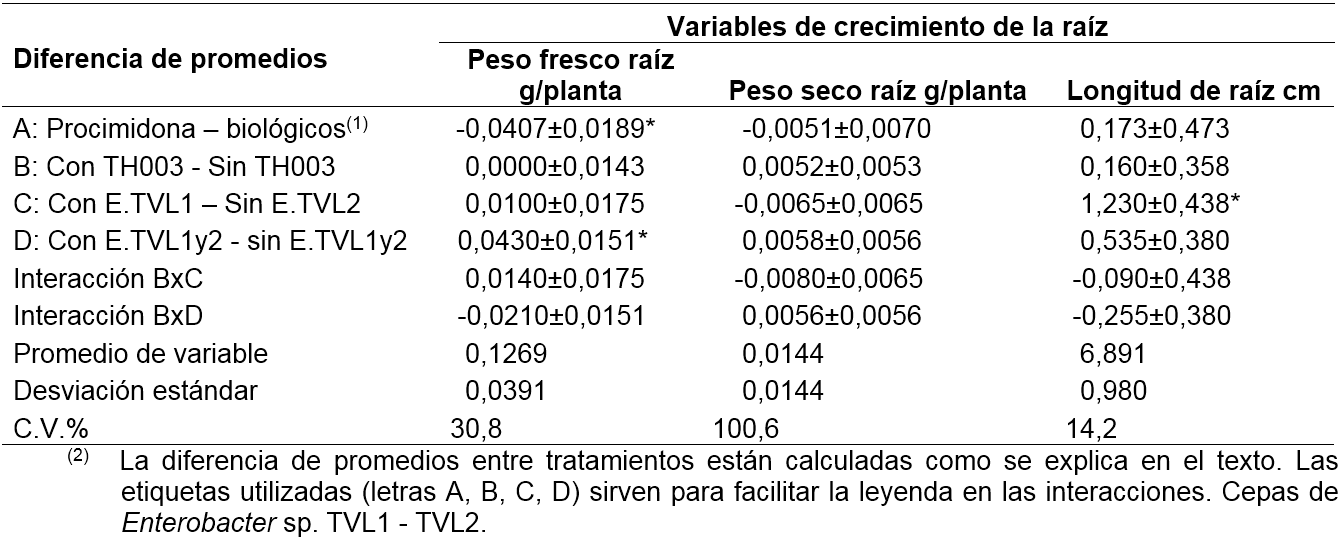
Muestreo destructivo en etapa de semillero. En las tablas 1 y 2 se presentan los resultados del análisis de varianza, en particular, de las diferencias de promedios entre tratamientos. Para cada comparación se asignó una etiqueta (A, B, C y D). En la comparación A, se evalúa la diferencia entre el promedio del tratamiento con procimidona y el promedio del resto de tratamientos. En B, se evalúa la diferencia entre el promedio de los tratamientos con TH003 y el promedio de los tratamientos sin TH003 (sea que incluyan o no E.TVL-1 o E.TVL-2). En C, se evalúa la diferencia entre el promedio de los tratamientos con E.TLV-1 y el promedio de los tratamientos con E.TVL-2. Finalmente, en D, se evalúa la diferencia entre el promedio de los tratamientos con E.TLV (sea 1 o 2), o el promedio de los tratamientos sin E.TLV (se excluye el tratamiento con procimidona). Estas comparaciones, por ser ortogonales, admiten interacciones (B con C, y B con D).
La aplicación de las bacterias Enterobacter sp. (TVL-1 y TVL-2) tuvo un efecto favorable en el crecimiento de las plántulas, tanto de la parte aérea como radical (tablas 1,2). Si se compara el promedio de los tratamientos que incluyen dichas bacterias, con el promedio de los tratamientos que no las incluyen, se obtienen las siguientes diferencias: peso fresco de la parte aérea/planta 0,22 g , peso seco aéreo/planta 9,8 mg, hojas/planta 0,45 ud, área foliar/planta 8,9 cm2, altura/planta 1,4 cm, peso fresco de la raíz/ planta 43 mg. Estas diferencias representan una ganancia en porcentaje respecto al promedio del crecimiento de una planta, así: peso fresco aéreo 46,9%, peso seco aéreo 23%, número de hojas 8,4%, área foliar 48,1%, altura de planta 17,3%, peso fresco de raíz 33,9%. La adición de las bacterias mejoró el crecimiento de las plantas, sin que se demostrara diferencia por efecto de los Enterobacter TVL-1 -TVL-2 (tabla 1: diferencia C).
En el peso fresco aéreo y la altura de planta, se observa una interacción del efecto de aplicar los Enterobacter sp., según se aplique o no T. koningiopsis TH003 (tablas 1). De acuerdo con esta interacción, el efecto de aplicar las Enterobacter sp., es mayor cuando se aplican solas, que cuando se aplican acompañadas de T. koningiopsis TH003. Es decir, por un lado, cuando se observan los tratamientos sin T. koningiopsis TH003, el peso fresco aéreo aumentó en un 32,3% (0,15 g/planta) con la aplicación de Enterobacter sp., respecto al testigo sin Enterobacter sp. Por otro lado, en los tratamientos con T. koningiopsis TH003, el peso fresco aéreo aumentó en sólo un 14,6% (0,068 g/planta) con la aplicación de los Enterobacter sp., respecto al testigo. Se concluye que el efecto de la aplicación de los Enterobacter sp., es más favorable sin la mezcla con; en cuanto T. koningiopsis TH003 se obtiene mayor peso fresco de la parte aérea de las plantas. De manera análoga, la altura de la planta aumentó más 1,13 cm, o el 13,8% con la aplicación de los Enterobacter sp., sin adiciones, que cuando se mezcló con T. Koningiopsis TH003. Estos resultados reflejan el grado de antagonismo en la acción de los dos tipos de agentes biológicos Enterobacter sp. y Trichoderma koningiopsis.
El efecto positivo de la aplicación de T. koningiopsis TH003 se hizo evidente únicamente en la altura de las plantas. Con, T. koningiopsis TH003 las plantas tuvieron 1,03 cm más de altura respecto a las plantas sin el biológico 12,6% respecto al promedio (tabla 1: diferencia B). Este efecto no se alteró significativamente por la mezcla de T. Koningiopsis TH003 con las bacterias de Enterobacter sp.
Tabla 1. Diferencias de promedios y error estándar de algunas variables de crecimiento de la lechuga en semillero, por efecto de tratamientos de biofertilización y control de enfermedades
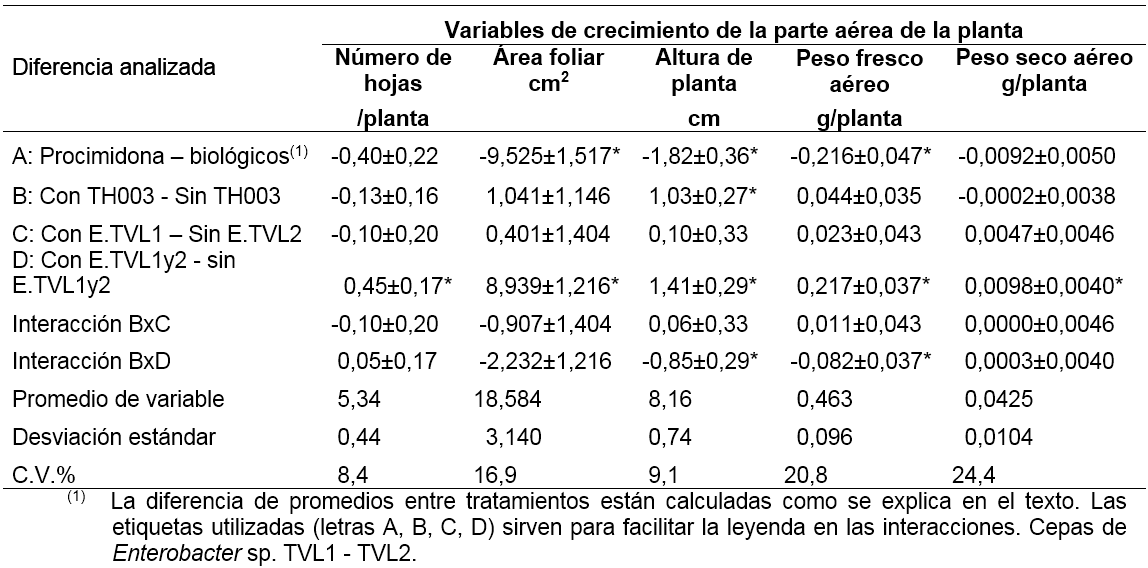
Por otro lado, la aplicación de procimidona demostró un efecto negativo en el crecimiento de las plántulas (tablas 1, 2). Las plántulas que recibieron procimidona desarrollaron menos peso fresco de la parte aérea 0,22 g/planta, menos área foliar 9,5 cm2/planta, menos altura de planta 1,8 cm, menos peso fresco de raíz 40,7 mg/planta, respecto a los tratamientos sin procimidona (biológicos). Estas diferencias, expresadas en porcentaje respecto al promedio de crecimiento de una planta, son: peso fresco aéreo 46,5%, número de hojas 8,4%, área foliar 51,2%, altura de planta 22,3% y peso fresco de raíz 32,1%. Este resultado indica que la procimidona tiene, en algún grado, efecto fitotóxico en las plántulas de lechuga.
Muestreo destructivo del cultivo de lechuga: Etapa de campo
En las tablas 3, 4, 5 y 6 se presentan los resultados del análisis de varianza, en particular, de la comparación de promedios de tratamientos. Las leyendas utilizadas se explican a continuación: “con P – sin P”, se refiere a la diferencia entre el promedio de los tratamientos con P (con fertilizante fosfórico) y el promedio de los tratamientos sin P; de manera análoga, la leyenda con la etiqueta A,
Tabla 2. Diferencias de promedios y error estándar de las variables de crecimiento de la raíz de lechuga en semillero, por efecto de tratamientos de biofertilización y control de enfermedades
se refiere a la diferencia entre el promedio de los tratamientos con E.TLV1, y el promedio de los tratamientos con E.TLV2; la etiqueta B se refiere a la diferencia entre el promedio de los tratamientos con E.TLV (sea E.TLV-1 o E.TLV-2) y el promedio de los mismos sin E.TLV; la etiqueta C se refiere a la diferencia del promedio de los tratamientos con TH003 y el promedio de los tratamientos con procimidona (se excluye el testigo absoluto); finalmente, la etiqueta D se refiere a la diferencia del promedio de los tratamientos de control biológico o químico, y el promedio del tratamiento testigo absoluto. Estas comparaciones son ortogonales. Las etiquetas E y F son interacciones de efectos según las etiquetas nombradas. Los efectos simples están nombrados indicando la etiqueta del efecto descrito acompañada del texto “sin P”, para referirse a los tratamientos que no recibieron P como fertilizante.
La interacción “F” en la tablas 3, 4 y 5 se refiere a un cambio significativo de la diferencia entre aplicar o no aplicar bacterias Enterobacter sp. (TLV1 y TLV2), según si el suelo tiene T. koningiopsis TH003 o procimidona. La diferencia medida en la planta se refiere al peso fresco aéreo de la planta, el área foliar y el número de hojas por planta. Esta interacción se presenta únicamente cuando no se aplica fertilizante fosfórico al suelo (tabla 3 y 4: F sin P). Cuando se aplica al suelo T. Koningiopsis TH003, y se comparan los tratamientos con y sin Enterobacter sp., se observa que la diferencia no es significativa (tablas 3 y 4: con E.TLV1 - E.TLV2 –sin E.TLV1 - E.TLV2, sin P, con TH003). Según este resultado, la aplicación en mezcla del hongo y las bacterias no afecta significativamente el crecimiento de las plantas. Cuando se aplica al suelo procimidona, y de nuevo, se comparan los tratamientos con y sin bacterias, se obtiene una diferencia significativa (tabla 6: con E.TLV 1 y 2 –sin E.TLV 1 y 2; sin P, con procimidona). Hay que recordar que en la fase de semillero se observó un efecto negativo de la procimidona sobre el crecimiento de las plantas. Ahora, en el ensayo de campo, el efecto de la aplicación de bacterias al suelo con procimidona, fue el de reponer el crecimiento de la planta a niveles similares al de los tratamientos sin procimidona. En este trabajo no se identificó el modo de acción de las bacterias para anular los efectos de fitotoxicidad por la procimidona. Sin embargo, es claro que existe una sinergia entre las bacterias y la procimidona, en cuanto que ambos productos se pueden combinar para que la planta no afecte su crecimiento y la procimidona pueda proteger la planta contra los ataques de hongos fitopatógenos. Según los promedios, puede evitarse el efecto fitotóxico de la procimidona aplicándolo conjuntamente con bacterias, por lo cual se recuperan 70,6 g de peso fresco aéreo por planta (16,9% de peso respecto al promedio del peso total por planta), junto con un aumento en el número de hojas (2,4 hojas/planta, que corresponde a un 6,6% del promedio total) y una mayor área foliar (1.069,3 cm2/planta, que corresponde a un 14,4% del promedio total).
La alternativa de manejo de lechuga mezclando T. koningiopsis TH003 y los Enterobacter sp. (TVL-1, TVL-2) presenta la ventaja, respecto al tratamiento con T. Koningiopsis TH003 sin los Enterobacter sp. (TVL-1, TVL-2) de un mayor desarrollo de peso seco de raíz: 0,93 g/planta (Tabla 3), efectos simples de tratamientos, con E.TVL1 - E.TVL2 - sin E.TVL1 - E.TVL2, sin P, con TH003, que corresponde a un aumento del 40,8% respecto al promedio de peso seco de raíz por planta. En este sentido, el efecto de T. Koningiopsis TH003 con Enterobacter sp. TVL2 fue superior al T. Koningiopsis TH003 con Enterobacter sp. TVL-1, en cuanto que con el primero las plantas ganaron 1,25 g de peso seco de raíz/planta respecto al segundo, lo cual corresponde a un porcentaje del 55,1% del promedio del peso seco total de la raíz por planta (tabla 5: E.TVL1 - E.TVL2; sin P, con TH003). Aunque esta ventaja no se manifestó en un mayor crecimiento de la parte aérea de la planta, es un atributo que puede representar ventajas en condiciones adversas de crecimiento, a evaluar en futuros ensayos. Además, representa un efecto sinérgico entre estos dos agentes biológicos, que no fue evidente a nivel de semillero.
Finalmente, es importante señalar que la aplicación del fertilizante fosfórico no fue favorable para el crecimiento de la planta de lechuga, y anuló el efecto que pudieron tener los tratamientos biológicos al suelo. Las plantas fertilizadas con fósforo presentaron menor peso fresco aéreo (95,6 g menos, que corresponde a una reducción del 22,9% de una planta promedio) y menos área foliar (970,4 cm2/ planta, una reducción del 13,0%), respecto a las plantas que no recibieron la fertilización fosfórica (tablas 3 y 4: con P - sin P). Únicamente la longitud de la raíz de la lechuga fue mayor cuando se aplicó fertilización fosfórica al suelo, respecto al tratamiento sin fósforo 1,28 cm, que corresponde a una variación del 7,4% respecto al promedio de longitud de las plantas en el experimento (tabla 5). Este resultado hace énfasis en que la aplicación de biofertilizantes debe considerar cuidadosamente los niveles de nutrientes en el suelo y la conveniencia de aplicar o no fertilizantes químicos.
En los parámetros de crecimiento de la lechuga (Lactuca sativa), las plantas bajo el efecto de los tratamientos Enterobacter sp. (TVL-2 y TVL-1) combinados con el biocontrolador T. koningiopsis TH003 mostraron en semillero mayor altura de planta, número de hojas, peso seco radical y área foliar. Las plántulas bajo el tratamiento E.TVL-2+TH003 obtuvieron mayor crecimiento con 6 hojas y 9 cm de altura, alcanzando los requerimientos para ser comercializadas. Estos resultados corroboran lo señalado por Pineda (2011), los cuales indica que en el trasplante se utilizan plantas con 3 a 5 hojas con color verde intenso y sin problemas fitosanitarios. Adicionalmente, la variable área foliar de los tratamientos E.TVL-1 y TH003+E. TVL-2 presentó diferencias significativas; según Robledo (2009), un óptimo desarrollo del área foliar permite una máxima absorción de la radiación solar y así mismo un mejor desarrollo fisiológico. En cuanto al peso seco aéreo y radicular el factor E.TVL-2+TH003 presentó diferencias significativas con el testigo absoluto y químico. Algunos autores como Garcia et al. (2011), consideran que datos altos en altura, materia seca de la raíz y parte aérea en plántulas de hortalizas, reflejan una mejor calidad de la plántula y por ende un buen estado de nutrición, lo que aumenta la resistencia de la
Tabla 3. Estimaciones por mínimos cuadrados de las diferencias de promedio en las variables de crecimiento entre distintas agrupaciones de tratamientos de manejo de la fertilización y la sanidad del cultivo de la lechuga
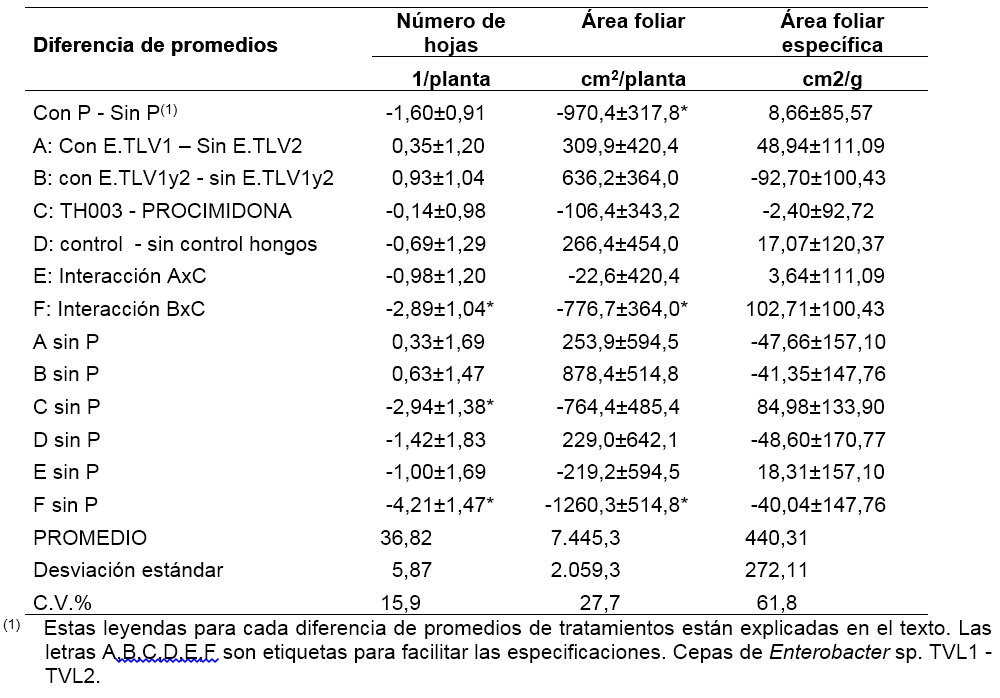
Tabla 4. Estimaciones por mínimos cuadrados de las diferencias de promedio en el peso aéreo de las plantas entre distintas agrupaciones de tratamientos de manejo de la fertilización y la sanidad del cultivo de la lechuga
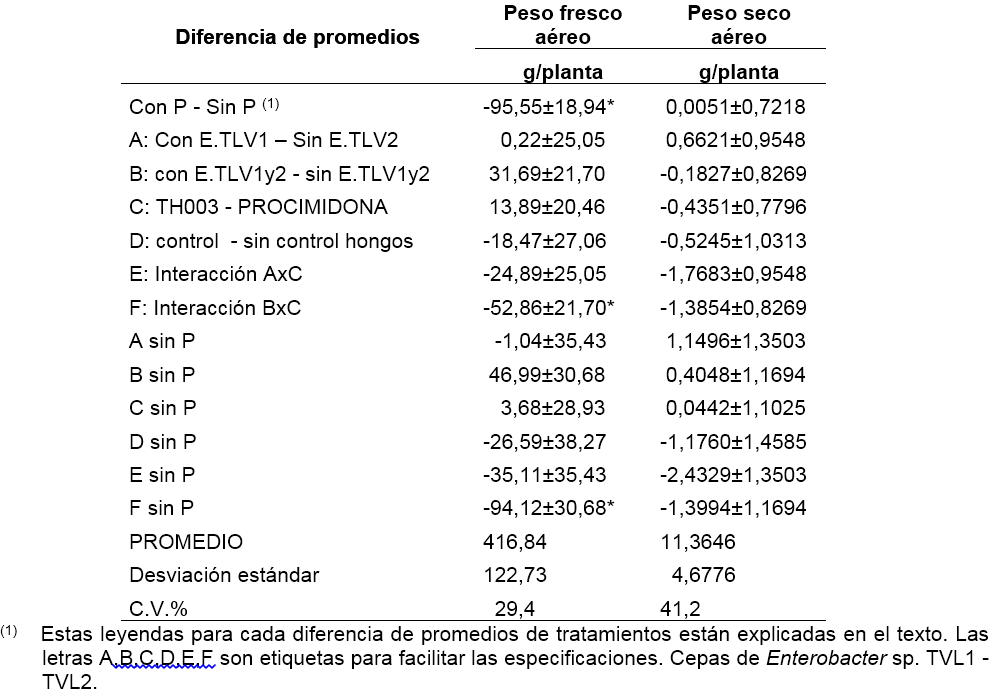
Tabla 5. Estimaciones por mínimos cuadrados de las diferencias de promedio en las variables de crecimiento de la raíz de las plantas entre distintas agrupaciones de tratamientos de manejo de la fertilización y la sanidad del cultivo de la lechuga
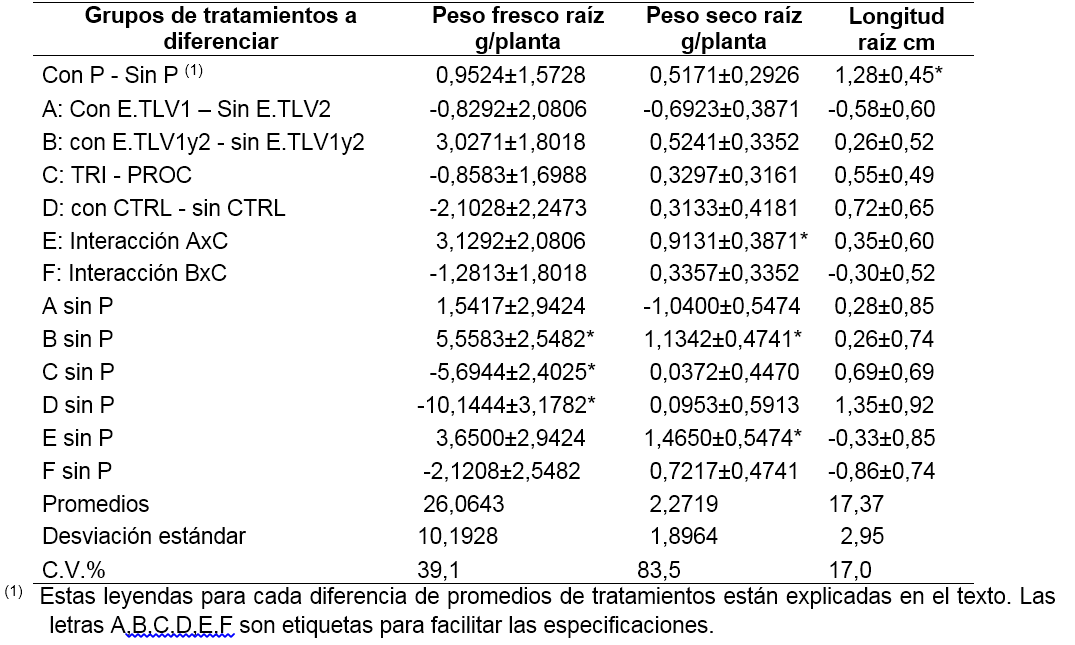
Tabla 6. Estimaciones por mínimos cuadrados de las diferencias de promedio de variables de crecimiento de las plantas entre distintas agrupaciones de tratamientos de manejo de la fertilización y la sanidad del cultivo de la lechuga (efectos simples)
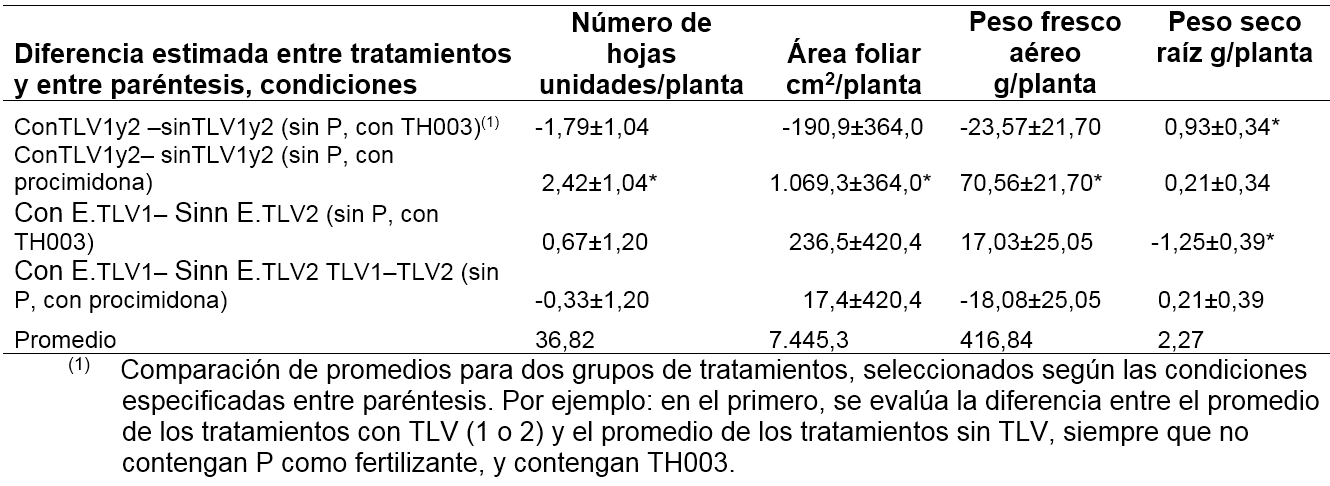
planta frente a patógenos y enfermedades en el momento del trasplante. Los resultados del muestreo destructivo en campo evidenciaron que el tratamiento que presentó el mayor peso fresco de cabeza promedio fue el E.TVL2+procimidona sin fertilización, con 525,1 g/ cabeza, lo que corresponde a un rendimiento de producción por hectárea de 40,84 t ha-1.
Este potencial no se observa en los ensayos experimentales de otros investigadores. Según Pineda (2011) reporta un rendimiento de 10,31 t ha-1 por aplicar 0,5 t ha-1 de fertilizante orgánico (Lonite) a un cultivo de lechuga Batavia. Guamán (2010) afirma que el rendimiento óptimo de lechuga de cabeza es de 24,5 t ha1. En cuanto la variable peso seco aéreo, el valor promedio más alto por tratamiento fue de 13,74 g, (TVL2+procimidona), superior al valor de 9,26 g que registró Escalona et al. (2009) con la aplicación de fertilizante orgánico combinado con nitrato de calcio, e inferior al valor de 21,4 g encontrado por Carranza et al. (2009). Las variables número de hojas y área foliar presentaron una relación positiva con el peso seco aéreo, de modo que el tratamiento
E.TVL-2+Procimidona (SF), de mayor peso seco de cabeza, también obtuvo el mayor número de hojas promedio por planta (40,17) y fue el segundo en área foliar (9.040,91 cm2/planta). Este valor de área foliar resultó superior al reportado por Carranza et al. de 8.162,45 cm2 /planta. Jarma et al. (2005), confirmaron la misma relación directa entre el área foliar y el peso seco, pues el aumento de la primera afecta de manera significativa a la segunda. Con respecto a la variable Índice de Área Foliar (IAF) el tratamiento E.TVL-2+Procimidona (SF) obtuvo uno de los valores más altos con 7,03 m2/m2, resultado inferior a los encontrados en el momento de la cosecha por Carranza et al. 2009, bajo condiciones de estrés por salinidad, quienes encontraron valores de IAF de 12,7 m2/ m2. En cuanto al Área Foliar Especifica (AFE), las plantas con mayor AFE recibieron la aplicación de TH003 con fertilizante, con 1.233,87 cm² g-1 y las de menor AFE fue E.TVL-2+Procimidona (CF). Amaro et al. (2004), afirma que una elevada AFE incrementa la fragilidad y apetencia de las hojas, del mismo modo que aumenta el riesgo por pérdidas prematuras de tejido; en contraste, un menor valor de la AFE implica mayor lignificación y baja concentración de nitrógeno. La reducción en esta variable se atribuye a una alteración de la hoja, o bien al incremento en concentración de nutrimentos y carbohidratos no estructurales. Schoebitz (2006) al evaluar, aislar y caracterizar bacterias promotoras de crecimiento vegetal de la rizósfera halló que la promoción del crecimiento evidenciada en L. perenne incremento el desarrollo de la zona aérea y radical, destacando el aumento en peso seco de brotes en un 30% en plantas de 50 días posterior a la inoculación, también encontró un aumento de pelos absorbentes en tomate y alfalfa que sugiere una promoción del crecimiento radical. Sánchez et al. (2012) al evaluar el efecto de la inoculación con Enterobacter sp. TVL-1 y TVL-2 sobre el cultivo de tomate, observó que las bacterias tuvieron algunas de las características asociadas a promoción de crecimiento vegetal in vitro-solubilización de fósforo, actividad fosfatasa, síntesis de fitohormonas (AIA), producción de sideróforos, evidenciando en invernadero un efecto positivo sobre el cultivo de tomate al variar los niveles de fertilización fosfórica. Estimulando el mayor desarrollo de la raíz y proporcionando la capacidad de absorción de nutrientes se la raíz en beneficio de la planta (Izaguirre et al. 2007). Sánchez et al. (2014) reportó experimento en invernadero, que las cepas Pseudomonas fluorescens FR1, Pseudomonas sp. FR2 y UVLO27 incrementaron de manera significativa (P<0,05) la biomasa y el desarrollo de las plantas de lechuga Lactuca sativa cultivar White Boston.
Se evidenció en las dos últimas semanas, sintomatología posiblemente debida a Sclerotinia sp,, cabe enunciar que ninguna de las plantas alcanzaron una severidad en el ataque del 50%, lo cual coincide con lo reportado por Osorio et al. (2005), quienes al evaluar la acción de Trichoderma lignorium en el control de Sclerotinia sp., en lechuga hallaron que el ataque se presentaba en las dos últimas semanas de cultivo y confirmaron que la severidad del ataque fue alrededor del 25% en el testigo absoluto, debido a las condiciones de humedad prevalecientes a lo largo de dicho ensayo. En relación a la incidencia del hongo, los tratamientos TH003 y TH003+E.TVL-2, tuvieron una incidencia de 0,35% en contraste con el testigo absoluto fertilizado que obtuvo un 10,71%, datos inferiores a los encontrados por Arias et al. (2007), quienes al evaluar tres métodos de control de Sclerotinia sp., determinaron que el tratamiento con menor incidencia fue procimidona con 3,3% y el más afectado fue el testigo absoluto con 18,3%. En contraste Martínez (2008), registró que la incidencia de la enfermedad comenzó a los 42 días del trasplante con un 10,3% y a los 72 días se presentó un 51%. Ibarra y Azucena (2008) verificó que cepas aisladas de Trichoderma no mostraron la misma capacidad de controlar a Sclerotinia sp.; lo anterior sugiere la existencia de factores ambientales que determinan la efectividad de dichas cepas para controlar o atenuar los daños de los patógenos en las plantas. El método más eficaz en este ensayo para el control de Sclerotinia sp., y hongos patógenos, fue el uso del ingrediente activo procimidona (las plantas bajo este tratamiento no evidenciaron la existencia de enfermedades), sin embargo, se debe combinar su uso con un producto biológico como Trichoderma koningiopsis, por ser una alternativa para la reducción del patógeno en campo (Martínez 2008). Cano (2011) en un artículo de revisión hallaron que las interacciones de los microorganismos como Pseudomonas sp., hongos formadores de micorrizas arbusculares y Trichoderma sp. en la rizósfera contribuyen al control biológico de patógenos y a la estimulación del crecimiento vegetal.
CONCLUSIÓN
Las plantas de lechuga cuyo manejo de enfermedades se realizó por medio del producto biológico Trichoderma koningiopsis TH003, tuvieron una incidencia del ataque de Sclerotinia sp., inferior al 0,35%; mientras que el testigo absoluto (CF) presentó una incidencia de 10,71%, demostrando que este producto biológico contribuye al control de enfermedades del cultivo y por tanto se pueden reducir las aplicaciones del fungicida químico procimidona.
La aplicación de fosfato diamónico como fuente de fósforo al suelo tuvo un efecto negativo en el crecimiento de las plantas de lechuga. Los tratamientos con Enterobacter sp., cepas TLV1 y TLV-2 con procimidona que no recibieron la fertilización fosfórica presentaron mayor crecimiento y rendimiento de producción de cabeza en comparación con los tratamientos que se fertilizaron.
Los niveles de infestación de Sclerotinia fueron bajos en general, esto se debió a la baja incidencia de este hongo en la parcela sembrada, pudo ser por subir la altura de las camas de siembra y por haber dispuesto una capa de mulch sobre el cultivo, prácticas que ayudaron a reducir el nivel de humedad de las camas sembradas y por tanto a desfavorecer el desarrollo del hongo.
La aplicación de procimidona tuvo un efecto negativo para el crecimiento de las plántulas en semillero. Sin embargo, la combinación de procimidona con los Enterobacter sp., anuló dicho efecto en campo, con lo cual las plantas lograron un mejor desarrollo fenológico comparado con el uso de TH003 como biofungicida.
RECOMENDACIONES
La aplicación de bacterias promotoras del crecimiento vegetal en cultivos de importancia agrícola como la lechuga, es una alternativa viable, sobre todo en los países con una agricultura subdesarrollada que carecen de fertilizantes o abonos químicos con elevado precio. En la agricultura estos microorganismos se postulan como alternativa prometedora para reducir el uso de agroquímicos y a mitigar el impacto adverso en el medio ambiente.
REFERENCIAS
Amaro, J., Garcia, E., Enriquez, J., Quero A., Perez, J., y Garay, A. 2004. Análisis de crecimiento, área foliar específica y concentración de nitrógeno en hojas de pasto “mulato” (Brachiaria hìbrido, cv.). Tèc. PerùMèx; Vol.42. 448 p.
Arias, L., Tautiva, L., Piedrahíta, W. y Chaves, B. 2007. Evaluación de tres métodos de control del Moho blanco (Sclerotinia sclerotiorum (Lib.) de Bary) en lechuga (Lactucae sativa L.). Agro. Colomb. 25(1):131-141.
Cano, M. 2011. Interacción de microorganismos benéficos en plantas Micorrizas, Trichoderma spp. Y Pseudomonas spp. Una revisión. Facultad de Ingeniería Agronómica. Universidad de Ciencias Aplicadas. Artículo Técnico Cano. Rev. U.D.C.A Act. &Div. Cient. 14(2):15-31.
Carranza, C., Lanchero, O., Miranda, D., y Chaves, B. 2009. Análisis del crecimiento de lechuga (Lactucae sativa L.) ‘Batavia’ cultivada en un suelo salino de la Sabana de Bogotá. Agro. Colomb. 27(1). 43p.
Escalona, A., Santana, M., Acevedo, I., Rodríguez, V. y Merú, L. 2009. Efecto del nitrógeno amoniacal y nítrico con o sin enmienda orgánica sobre el crecimiento y rendimiento de la lechuga (Lactucae sativa L.) CV Great Lakes. Rev. Unell. Cienc. Tec. Vol 27.16 p.
García Morales, C., Gaytán, T., Oswaldo, R., López Sánchez, H., López, P., Mora Aguilera, G. yTlapal Bolaños, B. 2011. Calidad de plántulas de chile’poblano’en la Sierra Nevada de Puebla, México. Revista fitotecnia mexicana, 34(2): 115121.
Ibarra y Azucena. 2008. Aislamiento y selección de cepas de Trichoderma para el control biológico de Sclerotinia sclerotiorum (Lib.) de Bary y Sclerotinia minor Jagger. http://hdl.handle.net/10521/1239 [Accedido: 08 24 2015].
Izaguirre, M. Labandera, C. y San Juan, J. 2007. Biofertilizante en Ibero America: visión Técnica, científica y empresarial. Rev.Cub. Cienc.Agric. 22:107-149.
Jarma, A. Rengifo, T. y Araméndiz, H. 2005.
(Aspectos fisiológicos de estevia Steviare baudiana Bertoni) en el área Caribe colombiano: I. Efecto de la radiación incidente sobre el área foliar y la distribución de biomasa (Online). Agronomía Colombiana 23(2): 207-216.
Martínez, Z. 2008. Algunos aspectos epidemiológicos del moho blanco de la lechuga (Lactucae sativa) en dos municipios productores de Cundinamarca. Trabajo de grado. Microbiología industrial. Facultad de ciencias. Pontificia Universidad Javeriana. Bogotá D.C.
Ministerio de Agricultura y Desarrollo Rural. 2009. Anuario estadístico de frutas y hortalizas 2004 - 2008 y sus calendarios de siembras y cosechas. http://www.Asohofrucol.gov.co/estadisticas,pdf. [Accedido: 08 24 2015].
Ministerio de Agricultura y Desarrollo Rural. 2013. Anuario estadístico del sector agropecuario 2013. http://www.mgap. gub.uy/Dieaanterior/Anuario2013/DIEA_ Anuario_2013.pdf. [Accedido: 08 24 2015].
Osorio, M., Vázquez, L., Salgado M. y González, C. 2005. Efecto de dos enmiendas orgánicas y Trichoderma sp. para controlar Sclerotinia sp. En Lechuga.Rev. Chapingo serie horticultura. 11(2). 203-208.
Pineda, D. 2011. Respuesta del cultivo de lechuga (Lactucae sativa L.) a la aplicación de tres abonos líquidos a tres dosis en la zona de Pimampiro, Provincia de Imbarura. Facultad de ciencias agropecuarias. Escuela de Ingeniería Agronómica, Sede El Angel. El Angel, Ecuador.
Porcel, R., Zamarreño, Á., García-Mina, J. and Aroca, R. 2014. Involvement of plant endogenous ABA in Bacillus megaterium PGPR activity in tomato plants. BMC plantbiology 14 (1): 36.
Sánchez, D., García, A., Romero, F., y Bonilla, R. 2014. Efecto de rizobacterias promotoras de crecimiento vegetal solubilizadoras de fosfato en Lactuca sativa cultivar White Boston. Revista Colombiana de Biotecnología. 17(2): 122-128.
S Sánchez, D., Gómez-Vargas, R., Garrido, M., y Bonilla, R. 2012. Inoculación con bacterias promotoras de crecimiento vegetal en tomate bajo condiciones de invernadero. Revista mexicana de ciencias agrícolas, 3(7), 1401-1415.
Sánchez, D. 2011. Efecto de la inoculación con bacterias promotoras de crecimiento vegetal sonre el cultivo de tomate (Solanum Lycopersicumvar. Sofía) bajo invernadero. Pontificia Universidad Javeriana. Tesis de maestría. Facultad de Ciencias. Bogotá D. C.
Schoebitz, M. 2006. Aislamiento y caracterización de bacterias promotoras de crecimiento vegetal de la rizósfera de Lolium perenne L. de suelo volcánico (modelo género Azospirillum spp.) Tesis de grado. Universidad Austral de Chile. Facultad de Ciencias Agrarias. Escuela de Agronomía. Valdivia-Chile.
Toro, M., Blones, J, Hernández, I. 2013. Dinámica del fósforo y actividad biológica en las micorrizósferas de dos ecosistemas adyacentes con vegetación y suelos contrastantes. Acta Biológica Venezuélica. 21(2): 21-28.
Universidad Nacional de Colombia. 2009. Exceso de tóxicos en hortalizas de la Sabana.http://www.unperiodico.unal. edu.co/dper/article/exceso-de-toxicosen-hortalizas-de-la-sabana/index.html. [Accedido: 08 24 2015].