Efecto de micorrizas nativas y fósforo en los rendimientos del maíz en Guárico, Venezuela
Effect
of native mycorrhizal and phosphorus in corn yields in Guárico, Venezuela
Eliecer M. Cabrales H[1]*, Marcia Toro[2] y Danilo Lopez-Hernández2
Recibido para publicación: Abril 25 de 2016 - Aceptado para publicación: Octubre 13 de 2016
RESUMEN
En suelos de sabana del estado Guárico – Venezuela, se evaluó la eficiencia de cuatro especies de hongos formadores de micorrizas nativa y su mezcla: Scutellospora pellucida, Scutellospora calospora, Glomus leptotichum y Acaulospora mellea en la toma de N y P, y su efecto en los rendimientos del cultivo de maíz hibrido HIMECA 3005 con 4 dosis de P (0, 27, 54 y 80 kg ha-1 de P2O5). Se sembró a 0,9 m entre hileras y 0,4 m entre plantas, la cuantificación del P y N foliar se hizo muestreando la hoja opuesta a la mazorca, por los métodos de Murphy – Riley y destilación con Kjeldalh; los redimientos se evaluaron en los tres surcos centrales de cada parcela. Se utilizó un diseño de bloques al azar con arregló factorial. Encontrándose que las dosis de P y los morfotipos evaluados influyeron en la toma de N y P, siendo 54 kg ha-1 de P2O5 y la mezcla de inóculos los de mejor eficiencia para la toma de N; mientras que la dosis de 54 kg ha-1 de P2O5 más Scutellospora pellucida para la toma de P. Se concluyó que estos inóculos pueden disminuir la aplicacion de P en un 25% e incrementar los rendimientos del maíz hasta en un 100% (de 2 a 4 t ha-1) con base en la producción de la zona.
Palabras clave: Mycorrhizae, savanna soils, nutrient absorption.
ABSTRACT
This study evaluated the efficiency of 4 native species of fungi mycorrhizal and mixing Scutellospora pellucida, Scutellospora calospora, Glomus leptotichum and Acaulospora mellea in absortion N and P and its effect on crop yields of hybrid corn HIMECA 3005 with 4 doses of P (0, 27, 54 and 80 kg ha-1 of P2O5). The study took place in soils of sabanna of Guarico state – Venezuela. Fungi were seeded at 0,9 between rows and 0,4 m between plants, sampling was done in the opposite leaf the corn cob in flowering stage. Quantification of P and N leaf was made by Murphy - Riley and distillation Kjeldalh respectively, whereas yields were evaluated in the three central rows of each plot. A randomized block design with factorial arrangement was used, the ANAVA, It was performed with Statistic 8.0. Findings revealed that doses of P and evaluated morphotypes influenced the decision-N and P in the corn plant, 54 kg ha-1 of P2O5 and consortium of inoculants those of better efficiency for the taking of N; while the dose of 54 kg ha-1 de P2O5 and Scutellospora pellucida formaking of P. It was concluded that these two inoculants can decrease the dose of P to 25% and increase maize yields by up to 100% based on the production of the area (2000 kg ha-1).
Key words: cassava forage, dry matter, crude protein, acid detergent fiber.
[1] * Ph.D. Docente área de suelos, Universidad de Códoba, ecabralesh@yaoo.es Tel 58-4-7860255.
[2] Ph.D. Docentes Facultad de Ciencias, Universidad Central de Venezuela
INTRODUCCIÓN
Los suelos de sabanas tropicales caracterizados por su vegetación de bajo porte (pasturas), escasos arbustos, altas temperaturas, lluvias estacionales y quemas frecuentes suelen ser de baja fertilidad en su mayoría, aunque algunas sabanas ubicadas en zonas bajas, pueden ser fértiles y de mucha utilidad en la explotación agropecuaria. Estos suelos de sabanas son comunes en África, India, sudeste asiático, Australia septentrional, y en América del sur en países como Colombia, Brasil, y Venezuela, entre otros (Gil y Alvarado 2012; Sarmiento 1983). Se estima que en Sur América hay cerca 270 millones de hectáreas, distribuidas así: 207 millones en Brasil, 28 millones en Venezuela, 17 millones en Colombia, 14 millones en Bolivia y 4 millones en Guyana (Rivera et al. 2012; Gómez y Paolini 2011). Son muy comunes los incendios en estas zonas en las épocas de sequia, dando origen año tras año a renovaciones naturales de su vegetación (Groombridge and Jenkins 2002; Hernández-Valencia y López-Hernández 2002).
En Venezuela, estos suelos de sabanas están localizados en los Estados de Monagas, Anzoátegui, Guárico, Cojedes, Apure, Bolívar, Amazonas (Chicco y Godoy 2005), y su principal uso está en la agricultura y ganadería, siendo este último el que abarca mayor área, en ambos casos, la productividad es baja. Las sabanas del Estado Guárico que abarcan gran extensión, no son la excepción de tener baja oferta nutricional. Sin embargo, por la escasez de áreas agrícolas y la necesidad de producir alimento, parte de estos suelos son dedicados a la agricultura, destacándose el cultivo de maíz de secano, con rendimientos de 2000 kg ha-1 (Vielma et al. 2005). El alto uso de insumos para mejorar la productividad de estos suelos, hace que sea un sistema no sostenible; sin embargo, el afán del hombre en ampliar la frontera agrícola hacia este tipo de suelos, conlleva a utilizar mayor cantidad de insumos químicos que en su mayoría se pierden por lixiviación o se volatilizan, ocasionando consigo incremento en la contaminación ambiental del medio. El uso de biofertilizantes en estos suelos, podría ser una alternativa para mejorar su productividad agrícola sabiendo que entre el 90 y 97% de las plantas vasculares son capaces de hacer simbiosis con hongos micorrizicos (Barea 2003; Siqueira y Franco 1998; O’Connor et al. 2002; Smith and Read 2008), y que el maíz es una planta micotrófica (Bi et al. 2003; Bunemann et al. 2004; Hao et al. 2010; Rakshit y Bhadoria 2010; Faggioli y Freytes 2008; Chassaigne 2012), condición que contribuye a mejorar su sanidad, su fisiología y rendimientos, ya que gracias a las hifas de los hongos formadores de micorrizas (HFM) la planta explora un volumen edáfico mucho mayor (Schüßler et al. 2001; Kosuta et al. 2005; Román 2003). Como compensación de ello, el micosimbionte recibe de la planta los fotoasimilados que son vitales para su supervivencia.
La baja fertilidad de los suelos de sabanas y en especial la deficiencia de fósforo, es condición propicia para la formación de las asociaciones hongo-raíz (micorrizas) (Corredor et al. 2003; Vance et al. (2003). Investigaciones en estos suelos han demostrado que utilizando el 25% de la dosis de P en presencia de HMA, se pueden lograr rendimientos de maíz de hasta 3100 kg ha-1 (Hernández et al. 2007). En este sentido, Toro et al. (2000 y 2001), reportan la presencia de Acaulospora sp. (similar a Acaulospora mellea), Acaulospora scrobiculata, Acaulospora spinosa, Glomus etunicatum y Scutellospora sp., asociadas a cultivos de maíz en suelos de los llanos occidentales de Venezuela.
Con base en lo anterior, la presente investigación tuvo como objetivo evaluar la eficiencia de hongos del phylum Glomeromycota u HMA nativos de suelos de sabanas tropicales, en la toma de N-P y rendimientos del cultivo de maíz.
MATERIALES Y MÉTODOS
La presente investigación se realizó en suelos de sabana al sur-oriente del estado Guárico, Municipio Santa María de Ipire, Vereda El ‘Salao’, en la Estación Experimental La Iguana, de propiedad de la Universidad Nacional Experimental Simón Rodríguez, ubicada a 8° 25’ LN y 65° 25’ LO, a una altura de 80 a 120 m.s.n.m., temperatura promedia de 27,3 °C y una precipitación de 1369 mm anuales, con dos estaciones, una de lluvia y otra seca (Hernández et al. 2007). Se utilizaron 4 especies de hongos del phylum Glomeromycota reportadas por Toro (2007) como inóculos nativos de suelos de sabana del estado Guárico (Scutellospora pellucida, Scutellospora calospora, Glomus leptotichum y Acaulospora mellea) y la mezcla de estos.
Se utilizó el maíz híbrido amarillo HIMECA 3005 previamente lavado para extraer pesticidas protectores, sembrado a 0,9 m entre hileras y 0,4 m entre plantas, dos semillas por sitio, lo que correspondió a una densidad de siembra de 55.000 plantas/ha-1. Se dispusó en el fondo de cada sitio ocho gramos del inóculo. Todos los inóculos contenían 150 esporas/100 g de suelo. Los inóculos evaluados fueron M0: sin inoculación; M1: Scutellospora pellucida; M2: Scutellospora calospora; M3: Glomus leptotichum; M4: Acaulospora mellea y M5: mezcla de especies nativas. Las dosis de P fueron: 0, 27, 54 y 80 kg ha-1 de P2O5 y se utilizó como fuente de P el DAP. Para la fertilización nitrogenada y potásica se utilizaron 150 kg ha-1 de N fraccionado en 3 partes y 80 kg ha-1 de K en presiembra incorporado, según análisis químico de suelos (Tabla 1) y requerimientos del cultivo (150-80-80 de N-P2O5-K2O, Epstein y Bloom 2005).
Tabla 1. Análisis Químico de Suelos, Estación Experimental La Iguana al inicio del ensayo Estado Guárico-Venezuela.

La cuantificación del P y N absorbido por la planta se midió en la hoja opuesta a la mazorca se hizo mediante extracción por solución binaria (ácido sulfúrico: ácido perclórico, relación 4:1); la cuantificación del P por Murphy – Riley (1982); y el N por destilación con Kjeldalh (IGAC 2006; Sadzawka et al. 2007; Instituto de Edafología 1993). Igualmente, se evaluluó el rendimiento del grano. Se utilizó un diseño de bloques al azar con arregló factorial mediante programa Statistic versión 8.0, previa comprobación de los supuestos del ANAVA. Se aplicó la prueba de comparación de medias mediante la prueba de Scheffe con un nivel del 95% de confianza.
RESULTADOS Y DISCUSIÓN
Absorción de nitrógeno. Entre las medias del factor dosis de fósforo, se pudo observar que hubo diferencias entre no-fertilizadas y fertilizadas con P, sin embargo, entre estas últimas, no hubo diferencias de significancia estadística, pero se pudo notar que la mayor absorción de nitrógeno se logró cuando se aplicaron 54 kg ha-1 de fósforo al suelo, como se observa en la figura 1. Esta diferencia deja claro que el fósforo es vital para una buena absorción nitrogenada, en la medida que contribuye energéticamente en la planta en la formación de las moléculas de los ATP (Adenosín trifosfatos), como lo explica Marschner (1986), Azcón-Bieto y Talón (2008); Taiz y Zeiger (2006), quienes resaltan la importancia del P no solo en la producción final del fruto, sino en el crecimiento y desarrollo de la planta.
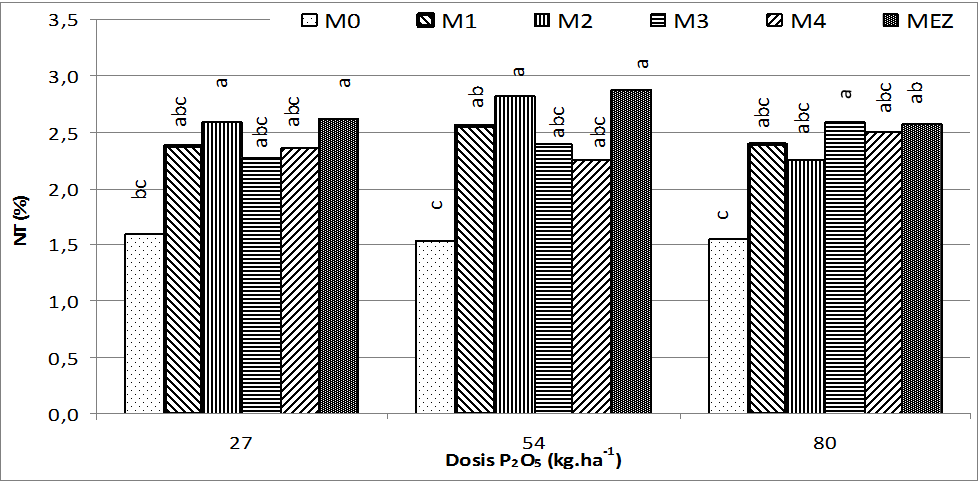
Figura 1. Contenido de nitrógeno total (NT) en la hoja opuesta a la mazorca del maíz híbrido HIMECA 3005 micorrizado y diferentes dosis de fósforo. M0 = Sin inoculación; M1 = Scutellospora pellucida; M2 = Scutellospora calospora; M3 = Glomus leptotichum; M4 = Acaulospora mellea y MEZo M5 = Consorcio de especies nativas. Letras distintas indican diferencias estadísticas significativas (p<0,05), según prueba de comparación de medias por Scheffe, CV = 10,61%.
Cuando se comparan las medias de absorción de nitrógeno del factor morfotipos, se puede observar que entre sin y con inoculación de micorrízas, hay diferencias estadísticas altamente significativas, pero entre las parcelas inoculadas no hay diferencia en la toma de N por la planta de maíz. Sin embargo, la mejor absorción se logró cuando se utilizó el consorcio de especies nativas (M5) figura 1. Las mayores concentraciones de nitrógeno se lograrón en plantas micorrizadas, lo cual ayudó a la toma de N del suelo, esto concuerda con las afirmaciones de Zepeda et al. (2010) y Azcón (2000) en torno a que los hongos micorrízicos HMA contribuyen en la toma de nutrientes del suelo en la medida se que se incrementa el volumen de suelo explorado.
De acuerdo a Epstein y Bloom (2005), por los valores encontrados en esta investigación (1,5 – 2,8% de N, figura 1) no hubo deficiencias de este elemento, ya que los niveles críticos para el maíz están por debajo de 1,46% de nitrógeno en las hojas. La literatura reporta diversidad de concentraciones de N foliar del maíz; Reta et al. (2007) encontró concentración de nitrógeno en hojas de cultivos de maíz sembrados en suelo de baja oferta nutricional que oscilaron entre 1,06 – 1,14%, muy por debajo de los que se reportan en esta investigación. Hao et al. (2010) en cultivos de maíz tipo convencional, reporta 1,4% de N en tejidos foliares. Sin embargo, Arrieche (2009) en suelos alfisoles venezolanos obtuvo concentración de nitrógeno entre 1,59 – 1,69% en las hojas, siendo suelos ácidos y de baja oferta nutricional, pero fertilizados y abonados orgánicamente. En los casos anteriores las cifras estuvieron por debajo de los valores obtenidos en esta investigación, lo que sugiere que la acción de los HMA contribuyerón favorablemente en la toma de nutrientes del suelo (Azcón 2000; Barea 2003; Martínez-García, 2011; Guerra 2008), tomando el N en forma amoniacal (Johansen et al. 1993; Frey and Schuepp 1993) o nítrica (Bago et al. 2001; Tobar et al. 1994; George et al. 1992).
Absorcion de fósforo. La concentración de este elemento en la hoja opuesta a la mazorca osciló entre 0,12% encontrada en la parcela con 54 kg ha-1 de fósforo y el tratamiento M5 (Mezcla de especies nativas), y 0,16% en la parcela con 27 kg ha-1 de fósforo y el inóculo 1 (Scutellospora pellucida) tabla 2. Las parcelas cuya concentración se reporta como nula, se debió a que no hubo hoja opuesta de mazorca al momento de muestreo para esta variable. Entre los valores encontrados en cada tratamiento, no hubo diferencias estadísticas significativas, pero se puede observar que con 27 kg ha-1 hubo mejor absorción de fósforo, posiblemente se deba a que con menor dosis de fósforo se establezca mejor la simbiosis micorrízica. En los tratamientos con 54 y 80 kg ha-1 de fósforo, hubo una disminución en la toma de este elemento, posiblemente al haber mayor cantidad de fósforo la eficiencia micorrízica para la toma de este elemento haya sido menor, comparada con las parcelas que recibieron 27 kg ha-1 de fósforo. Estos resultados son acordes a los reportes de Smith and Read (2008), Bi et al. (2004), Villate (2012), Toro et al. (2001), entre otros, quienes han indicado que los HMA hacen mejor la simbiosis bajo condiciones de bajos contenidos de fósforo en el suelo.
Tabla 2. Contenido foliar de fósforo en la variedad de maíz HIMECA 3005 en la etapa de floración, tratados con cuatro cepas de micorrizas nativas y fertilizadas con diferentes dosis de fósforo en el estado de Guárico Venezuela.

La comparación de las medias del factor Morfotipo, indica que no hubo diferencias significativas. Sin embargo, en la tabla 2, se puede ver que el Morfotipo 1 (Scutellospora pellucida) numéricamente mostró un ligero incremento; entre las parcelas inoculadas y las no inoculadas hubo la diferencia numérica. Las medias oscilaron entre 0,09% (parcelas sin inoculación) y 0,11% (parcelas inoculadas con el Morfotipo 1 (Scutellospora pellucida). Estas pequeñas diferencias logradas con la inoculación micorrízica fueron coherentes con las afirmaciones de Rakshit y Bhadoria (2010), quien en ensayos donde agregó fósforo a plantas de maíz micorrizadas, estas incrementaron de 0,07 a 0,22% el P en la planta.
En las medias en cada uno de los niveles del factor dosis de fósforo, presentan diferencia estadística significativa (p<0,05), encontrándose que la mejor dosis fue 27 kg ha-1 de fósforo, y la menor fue la de 54 kg ha-1, pero entre ésta y la de 80 kg ha-1 no hubo diferencias estadísticas tabla 2. Esto muestra que una baja dosis de fósforo puede contribuir a un mejor desarrollo de la asociación micorrízica y con ella, se puede compensar la toma de fósforo del suelo, pero hay la necesidad de hacer aplicación de este elemento, ya que el suelo es extremadamente pobre y el hongo solo lo transporta, de lo contario la planta mostraría deficiencias de estos elementos. En casos extremos, como los encontrados en esta investigación. Esto concuerda con las afirmaciones de Woomer et al. (2002) en cuanto a la necesidad de adicionar al suelo los nutrientes que la planta necesita para lograr buen desarrollo de la misma y contribuye de manera indirecta a una mejor actividad biológica del suelo.
En todos los tratamientos, los resultados obtenidos en esta investigación estuvieron por debajo de los 0,28 – 0,5% de fósforo que reporta Faggioli y Freytes (2008) en muestras aérea de maíz micorrizado en suelos de fertilidad moderada, y con contenidos adecuados en fósforo, mientras que en los suelos de la Estación Experimental La Iguana, hay poca oferta de este elemento y la planta tomaría muy poco sin la ayuda de los HMA. En este sentido, Rillig et al. (2003), Pattinson et al. (2006), Toro et al. (2000) y Toro et al. (2008), entre otros, consideran que en condiciones de bajos contenidos de P en el suelo, los HMA pueden ser una opción para mejorar la toma de este elemento, en la medida que mediante sus hifas exploran áreas donde las raíces no alcanzan a llegar, pudiéndolo tomar según Marschner (1986), Epstein and Bloom (2005), como P libre del suelo (H2PO4-, HPO42-, PO43-) y transportarlo mediante sus micelios extraradicales a la raíz (Ezawa et al. 2004).
Rendimiento. El análisis del factor dosis de fósforo arrojó diferencias significativas entre sus medias (p<0,05), siendo 54 kg ha-1 la mejor dosis cuya producción fue de 3325,9 kg ha-1, aunque entre ésta y la dosis de 80 kg ha-1 no hubo diferencias, con esta última se lograron 3241,0 kg ha-1. No obstante, la dosis de 27 kg ha-1 de fósforo fue la que mostró la media más baja, 2100 kg ha-1, cifra que está muy cercana a la media de rendimiento en la zona de sabanas del Guárico que son 2000 kg ha-1 (Vielma et al. 2005), como se puede observar en la figura 2. Esta diferencia denota que el uso del fósforo en estos suelos incrementa la producción del cultivo del maíz, y con una dosis intermedia y la ayuda de HMA, se pueden tener mejores resultados en la producción de maíz, toda vez que con ellos la planta se ayuda en su nutrición (Smith and Read 2008).
En la comparación de las medias del factor morfotipo se encontraron diferencias estadísticas significativas (p<0,05), la diferencia es más marcada entre plantas inoculadas y no inoculadas, siendo éstas últimas las que tienen el menor promedio, 1458,3 kg ha-1, como se aprecia en la figura 2. Pero entre las micorrizadas no hubo diferencias estadísticas. El morfotipo 4 (Acaulospora mellea) fue el que presentó la mayor producción con 2650,1 kg ha-1, seguidamente se ubica el morfotipo 5 (consorcio de especies nativas) con 2500,3 kg ha-1. Esto sugiere que en suelos de baja oferta en fósforo y con el uso de los HMA, se puede mejorar la media de producción entre un 30 y 80%, según el morfotipo y la cantidad de fósforo presente en el suelo, ya que con la simbiosis micorrízica, la planta suple requerimeintos nutricionales en términos generales, como lo afirmó Smith y Read (2008), Sánchez y Velásquez (2008), Barea et al. (2008).
Aunque estadísticamente no se haya encontrado diferencias significativas entre las medias de las combinaciones de los factores dosis de fósforo y morfotipos (figura 2), se aprecia que los rendimientos más bajos se presentaron cuando no se hacen inoculaciones micorrízicas y se utilizan dosis de fósforo muy bajas. Con dosis de 27 kg ha-1 de fósforo y los morfotipos 1 (Scutellospora pellucida) y 0 (sin inoculación), se obtuvieron los rendimientos más bajos, con medias de 1574,0 y 1691,2 kg ha-1, respectivamente, por debajo de la media que reporta Vielma et al. (2005) en las Sabana del Guárico-Venezuela. En la medida que se incrementó la dosis de fósforo mejoraron los rendimientos y se acentúa mas cuando hay inoculación micorrízica, por ejemplo, con 54 kg ha-1 de fósforo y sin inoculación, se tuvieron rendimientos de 2076,4 kg ha-1. Pero cuando se inocula el morfotipo 4 (Acaulospora mellea) y 5 (consorcio de especies nativas), estos rendimientos se incrementan a 4121,2 y 4087,6 kg ha-1, respectivamente. Aunque los máximos rendimientos se obtuvieron con la dosis de 80 kg ha-1 de fósforo y el morfotipo 4 (Acaulospora mellea), con una media de 4384,0 kg ha-1. Estas diferencias son de gran utilidad ya que al disminuir el 33% de la dosis de fósforo (27 kg ha-1) en presencia del hongo micorrízico, los rendimientos se disminuyeron en solo un 6%, que, para este caso, equivale a 262,2 kg de grano.
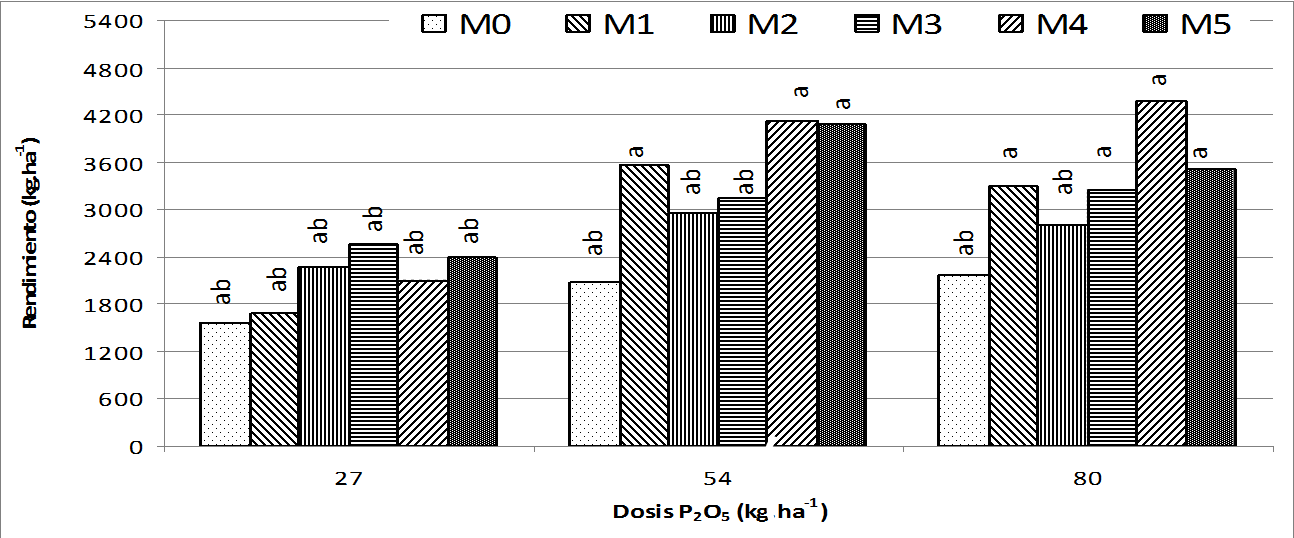
Figura 2. Rendimiento de grano de maíz híbrido HIMECA 3005 micorrizado y fertlizado con varias dosis de fósforo. M0 = Sin inoculación; M1 = Scutellospora pellucida; M2 = Scutellospora calospora; M3 = Glomus leptotichum; M4 = Acaulospora mellea y M5 = Consorcio de especies nativas. Letras distintas indican diferencias estadísticas significativas (p<0,05), según prueba de comparación de medias por Scheffe, CV = 27,95%.
Publicaciones relacionadas indican que los suelos de las sabanas del Guárico tiene una media de rendimiento de 2000 kg ha-1, con picos hsta de 2670 kg ha-1 (Vielma et al. 2005), cantidad superada en esta investigación con una dosis intermedia de 54 kg ha-1 e inoculación micorrízica, con cualquier géneros de los micosimbiontes evaluados, se supera dicha media, pero si no se inocula y se utiliza la misma dosis de fósforo, esta media estaría por debajo del promedio que reporta Vielma et al. (2005). Es decir, que, para tener buenos resultados en las sabanas del Guárico, el uso de HFM es una opción en la medida que se trabajen con dosis bajas de fósforo, esto en coherente con los reportes de Sánchez y Velásquez (2008) cuando afirman que baja dosis de fósforo en el suelo pueden ser subsanadas con inoculaciones de HFM, ya que estos hongos tienen la habilidad de explorar mayor volumen de suelo (Smith and Read 2008). Gracias a la eficiencia de los morfotipos micorrízico utilizados en la Estación Experimental La Iguana, se superaron los 2441 kg ha-1 que Uribe et al. (2007) obtuvieron en suelos mexicanos utilizando HFM en maíz, ambos con bajo contenido de P. En este sentido, Cardoso and Kuyper (2006) afirma que los suelos del trópico suelen ser deficientes en fósforo, y una alternativa para aprovechar lo poco que hay, dentro de un programa de sostenibilidad y que conlleva una alteración ínfima del medio edáfico, es el uso de hongos formadores de micorrizas.
CONCLUSIÓN
Bajo las condiciones edafoclimáticas de la Estación Experimental La Iguana del Estado Guárico – Venezuela se puede concluir qué:
Con el uso de los hongos Glomeromycota nativos de estos suelos, se puede reducir hasta en un 33% la fertilización fosfórica sin que esto repercuta en la absorción de N y rendimientos de producción de grano.
Los morfotipos Acaulospora mellea y el consorcio de especies nativas, son potenciales microorganismos que se pueden utilizar en la producción de biofertilizantes a base de hongos formadores de micorrizas en el cultivo de maíz en suelos de sabanas del Guárico con bajos valores de fósforo en el suelo.
REFERENCIAS
AOAC. 2005. Official Methods
of Analysis of AOAC International. 18th
Edition, Gaithersburg, Maryland 20877-2417.
Arrieche, I. 2009. Efecto de la fertilización orgánica y química en suelos degradados cultivados con maíz (Zea mays l.) en el estado Yaracuy, Venezuela. Tesis Ph.D. Departamento de Ciencias Agroforestales. Universidad de Valladolid – España. 210p.
Azcón, R. 2000. Papel de la simbiosis micorrízica y su interacción con otros microorganismos rizosférico en el crecimiento vegetal y sostenibilidad agrícola. En: Alarcón, A. y FerreraCerrato, R. (Eds). Ecología, Fisiología y Biotecnología de la Micorriza Arbuscular. México: Mundiprensa, p. 1–15.
Azcón-Bieto, J. y Talón, M. 2008. Fundamentos de Fisiología
vegetal. Segunda edición.
Madrid: McGraw-Hill – Interamericana. 134p.
Bago, B., Pfeffer, P. and Schachar-Hill, Y. 2001. Could the urea cycle be translocating nitrogen in the Arbuscular mycorrhizal symbiosis?. New Phytologist, 149(1): 4 – 8.
Barea, J.
2003. Las micorrizas arbusculares componente
clave en la productividad y estabilidad de agroecosistemas.
Departamento de Microbiología del Suelo y Sistemas Simbióticos, Estación
Experimental del Zaidín, Granada, España. 50 p.
Barea, J., Ferrol, N. and Azcón-Aguilar, R. 2008. Mycorrhizal symbioses. In The
ecophysiology of plant-phosphorus interactions. Series Plant Ecophysiology, 7:
143-163.
Bi, Y., Li, X., Christie, P., Hu, Z.
and Wong, M. 2003.
Growth and nutrient uptake of arbuscular mycorrhizal maize in different depths
of soil overlying coal fly ash. Chemosphere, 50: 863–869.
Bunemann, E., Smithson, P.,
Jama, B., Frossard,
E. and Oberson,
A. 2004. Maize
productivity and nutrient dynamic in maize-follow rotations in Western Kenya.
Plant and Soil, 264(1-2): 195–208.
Cardoso, I. and Kuyper, T. 2006. Mycorrhizas and tropical soil fertility. Agriculture, Ecosystems and Environment, 116(1): 72–84.
Corredor, G., Otálvaro, D. y Álvarez, C. 2003. Metodologías empleadas para el estudio de micorrizas arbusculares. Programa Nacional de Recursos Biofísicos, CORPOICA, Santa Fe de Bogotá. 45p.
Chassaigne, A., Barrientos, V. y Hernández, A. 2012. Obtención de una población de maíz para la tolerancia a factores adversos en tres estados de Venezuela. Bioagro, 24(3): 221 – 226.
Chicco, C. y Godoy,
S. 2005. Deficiencias minerales y condiciones asociadas en la ganadería de
carne de las sabanas de Venezuela. Primer Curso Internacional Sobre Avances en
la Nutrición de los Rumiantes en Venezuela. Maracay – Venezuela. Pp. 101-128.
Epstein, E. and Bloom, A. 2005. Mineral nutrition of plant:
principles and perspectives. Second edition. Sunderland: Sinaver
Associates, Inc. 380p.
Ezawa, T., Cavagnaro,
T., Smith, F. and Ohtomo, R. 2004. Rapid accumulation of polyphosphate
in extraradical hyphae of an Arbuscular mycorrhizal
fungus as revealed by histochemistry and
polyphosphate kinase/luciferase system. New Phytologyst, 161(2): 387 – 392.
Faggioli, V, y Freytes G. 2008. Micorrización natural de maíz y su relación con la absorción de fósforo del suelo en diferentes sistemas de labranzas y fertilización. XXI Congreso Argentino de la Ciencia del Suelo, Resúmenes CD-Rom.
Frey, D. and Schuepp,
H. 1993.
Acquisition of nitrogen by external hyphae of Arbuscular mycorrhizal fungi
associated with Zea mays L. New Phytologist,
124(2): 221 – 230.
George, E., Haussler, K., Vetterlein, G., Gorgus, E. and Marschner, H. 1992. Water and nutrient translocation by hyphae of Glomus mosseae.
Canadian Journal of Botany, 70(2): 2130 – 2137.
Gil, A. y Alvarado, C. 2012. Sabanas del mundo. Vicerrectorado de Investigaciones y Postgrado, Universidad de Yacambu, Venezuela. Online. http://www. slideshare.net/angelgil82/presentacinsabanas-del-mundo [Consultado, 15 de marzo 2016].
Gómez, Y. y Paolini, J. 2011. Variación en la actividad microbiana
por cambio de uso en suelos en sabanas, Llanos Orientales, Venezuela. Revista de Biología
Tropical, 59(1): 1 – 15.
Groombridge, B. and Jenkins, M. 2002. World Atlas of Biodiversity: Earth’s Living Resources in the 21st Century. USA: University of California Press, Berkeley, California. 340p.
Guerra, B. 2008. Micorriza arbuscular. Recurso microbiológico en la agricultura sostenible. Tecnología en Marcha, 21(1): 191-201.
Hao, H., You-Lu, B., Li-Ping, Y., Qing-Bo, K., Yan-Li, L., Lei, W., and Zhi-Yong, W. 2010. Response of Element Distribution of Various Organs of Maize to Fertilizer Application. Agricultural Sciences in China, 9(3): 401-407.
Hernández-Valencia, I. y Lopez-Hernandez, D. 2002. Pérdida de nutrimentos por la quema de la vegetación en una sabana de Trachypogon. Rev. biol. trop. 50(3-4): 1013 – 1019.
Hernández, R., Lozano, Z., Toro, M., Bravo, C., Rivero, C., Ojeda, A. y Morales, Y. 2007. Manejo agroecológico de suelos de sabanas bien drenadas con unidades de producción cereal-ganado. Informe de avance. UNESR (IDECYT) – UCV (FAGRO-F. CIENCIAS) – UBV. 167p.
IGAC. 2006. Métodos analíticos del laboratorio de suelos. 6ª edición. Santa Fe de Bogotá: Instituto Geográfico Agustín Codazzi, IGAC. 648p.
Instituto de Edafología. 1993. Métodos de análisis de suelos y plantas utilizados en el laboratorio general del Instituto de Edafología. Maracay: Universidad Central de Venezuela sede Maracay. 89p.
Johansen, A., Jakobsen, I. and Jensen, E. 1993. Hyphal transport by
a vesicular-arbuscular mycorrhizal fungi of N applied to the soil as
ammonium or nitrate. Biology and Fertility of Soils, 16(1): 66 – 70.
Kosuta, S., Winzer, T. and Parniske,
M. 2005. Arbuscular mycorrhiza.
Pp. 87-95. In: Márquez, J. (Eds). Lotus japonicus Handbook. Netherlands: Springer.
Marschner, H. 1986. Mineral nutrition of higher plants. Second edition. USA: Academic Spress. 674p.
Martínez-García, L. 2011. Micorrizas arbusculares en ecosistemas semiáridos. Respuesta a factores de estrés ambiental. Ecosistemas, 20(2): 117 – 120.
Murphy, J. and Riley, J. 1982. A modified single solution method
for determination of phosphate in natural waters. Analytica
Chimica Acta, 27:31-36.
O’Connor, P., Smith, S. and Smith,
F. 2002. Arbuscular
mycorrhizas influence plant diversity and community structure in a semiarid herbland. New Phytologist,
154(1): 209–218.
Pattinson, G., Hammill, K., Sutton,
B. and Mcgee, P. 2006. Simulated fire reduces the density of
arbuscular mycorrhizal fungi at the soil surface. Mycological Research, 103(4):
491-496.
Rakshit, A. and Bhadoria, P. 2010. Role of VAM on growth and phosphorus nutrition of maize with low soluble phosphate fertilization. Acta Agronómica, 59(1): 119-123.
Reta, D., Cueto, J., Mascorro. A. y Santamaria, J. 2007. Rendimiento y extracción de nitrógeno, fósforo y potasio de maíz forrajero en surcos estrechos. Agricultura Técnica de México, 33(2): 145 – 151.
Rillig, M., Treseder,
K., and Allen, M. 2003. Global
change and mycorrhizal fungi.
Pp. 135 – 160. In: M.G.A., Van der Heijden and Sanders, I. (Eds.). Mycorrizal Ecology. Springer-Verlag, Heidelberg.
Rivera, M., Amézquita, E., Rao, I., Corrales, I. y Chávez, L. 2012. Efecto del establecimiento de sistemas agropastoriles en rendimiento de cultivos y características de suelo bajo siembra directa y labranza mínima en suelos ácidos de sabanas. Pp. 243 – 248. XVI Congreso Colombiano de la Ciencia del Suelo. Riohacha: Sociedad Colombiana de la Ciencia del Suelo.
Román, F. 2003. Concentración de reguladores del desarrollo vegetal inducidas por hongos endomicorrízicos en dos cultivares de chile (Capsicum annuum, L). Tesis Ph.D. Facultad Ciencias Biológicas y Agropecuarias. Universidad de Colima. México. 103p
Sadzawka, A., Carrasco, M., Demanet, R., Flores, H., Grez, R., Mora, M. y Neamam, A. 2007. Métodos de análisis de tejidos vegetales. 2da edición. Santiago de Chile: Instituto de Investigaciones Agropecuarias, Centro Regional de Investigación La Platina, Santiago de Chile. 120p.
Sánchez, M. yV elásquez, D. 2008. Las micorrizas: el micelio externo de los hongos Formadores de micorriza arbuscular (HMA). Cuadernos Ambientales Numero 12. Palmira – Valle: Universidad Nacional de Colombia. 16 p.
Sarmiento, G. 1983. The savannas of tropical América. Pp 245 – 288. In: Bourliere,
F. (Ed): Ecosistems of the world XIII. Tropical
Savannas. Amsterdam: Elsevier.
Schüßler, A., Schwarzott, D., and Walker, A. 2001. New fungal phylum, the Glomeromycota: Phylogeny and evolution. Mycological Research, 105:1413-1421.
Siqueira, J. y Franco, A. 1998. Biotecnología do solo. Fundamentos e perspectivas. Brasilia: MEC Ministerio de Educacao, ABEAS; Lavras: ESAL, Faepe. pp. 125127.
Smith, E. and Read, J. 2008. Mycorrhizal symbiosis. 3ra edition. New York: Elsevier, Acamic Press. 787p.
Taiz, L. y Zeiger, E. 2006. Fisiología vegetal, volumen 1. Madrid: publicaciones de la Universidad Jaume I. 580p.
Tobar, R., Azcón, R. and Barea, J. 1994. Improved nitrogen uptake and transport from 15N-labelled nitrate by external hyphae of Arbuscular mycorrhizal under water-stressed conditions. New Phytologist, 126(1): 119 – 122.
Toro, M. 2007. Micorrizas arbusculares en ecosistemas de sabana venezolanos. Pp. 243-267. En: Montaño, N., Camargo-Ricalde, S., García-Sánchez, R., y MonroyAta, A. (Eds.) Micorrizas arbusculares en ecosistemas áridos y semiáridos. México: Mundi-Prensa SA of CV, Instituto Nacional de Ecología-SEMARNAT, UAMIztapalapa, FES-Zaragoza-UNAM.
Toro, M., Alba, A., Casanova, E. y Salas, A. 2000. Estudio de la microflora solubilizadora de fosfatos y las micorrizas arbusculares en una sabana de el sombrero, estado Guárico. Acta Biológica Venezolana, 20(1):29-35.
Toro, M., Bazo, I. y López, M. 2008. Micorrizas arbusculares y bacterias promotoras de crecimiento vegetal, biofertilizantes nativos de sistemas agrícolas bajo manejo conservacionista. Agronomía Tropical, 58(3): 215 – 221.
Toro, M., Blones, J. y Hernández, I. 2001. Dinámica del fósforo y actividad biológica en las micorrizósferas de dos ecosistemas adyacentes con vegetación y suelos contrastantes. Acta Biológica Venezolana, 21(2):21-28.
Uribe, G., Petit, J. y Dzib,
R. 2007. Respuesta del cultivo de maíz a la aplicación de biofertilizantes en el sistema Rosa, Tumba y Quema de
suelos Alfisol (Chac lu-um, nomenclatura Maya) en Yucatán, México.Agricultura Andina, 13: 3 – 18.
Vance, P., Uhde-Stone, C. and Allan, L. 2003. Phosphorus acquisition and use: critical adaptations by plants for securing a nonrenewable resource. New Phytologist, 157(3): 423–447.
Vielma, M., Cerovich, M., Miranda, F. y Marín, C. 2005. Influencia de la semilla certificada de maíz en la productividad de los sistemas de producción de maíz en grano de los estados Portuguesa y Guárico. Agronomía Tropical, 55(3): 343 - 361.
Villate, R. 2012. Manejo biológico de los suelos. pp. 15 – 19. En: XVI Congreso Colombiano de la Ciencia del Suelo. Riohacha: Sociedad Colombiana de la Ciencia del Suelo.
Woomer, P., Mukhwana, E. and Lynam, J. 2002.
On-farm research and
operational strategies in soil fertility management. Pp. 313 – 337. In: Vanlauwe, B., Diels, J., Sanginga,
N. and Merckx, R. (Eds). Integrated plant nutrient
management in sub-Saharan Africa: from concept to practice. USA: CABI
publishing in association with the International Institute of Tropical
Agriculture.
Zepeda, S., Ambriz, E., Dasgupta-Schuber, N. y Villegas, E. 2010. Efecto de la interacción Glomus intraradices-nitrógeno sobre el pH, acumulación de fósforo y desarrollo de Tagetes erecta L. bajo condiciones de agobio hídrico. Biológicas, 12(1): 52–56.