Use of arbuscular mycorrhizal fungi (AMF) in the nutrition of Leucacephala leucocephala (Lam.) De wit for forage production
Uso de los hongos micorrízicos arbusculares (HMA) en la nutrición de Leucacephala leucocephala (Lam.) De wit para la producción de forraje

This work is licensed under a Creative Commons Attribution-NonCommercial 4.0 International License.
Show authors biography
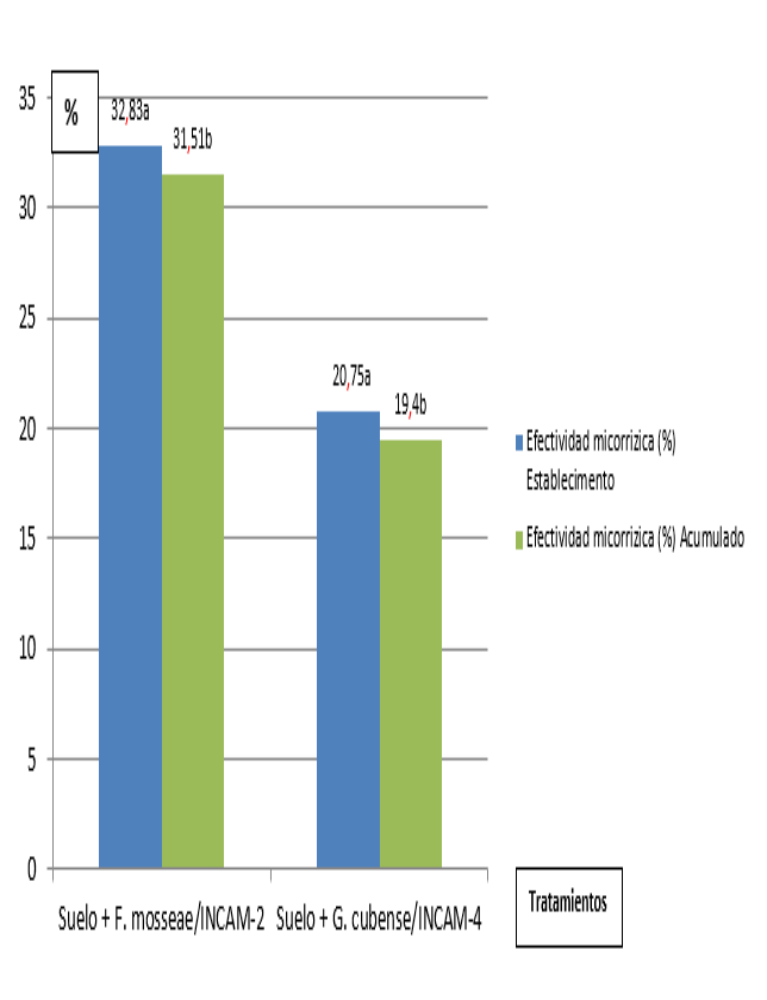
At present, the use of biofertilizers and protein plants in the nutrition of pastures and forage has increased. The investigation was carried out in the University Center of the municipality of Cumanayagua, county of Cienfuegos, Cuba with the objective of evaluating the response of Leucaena leucocephala (Lam.) De Wit to the inoculation of different arbuscular mycorrhizal fungi (AMF) strains. The experiment was carried out in polyethylene bags. The experiment used a random blocks design with three replicates and the following treatments: #1. Soil (Control treatment, without inoculation and NPK application), #2. Soil + inoculation with the AMF strain F. mosseae/INCAM-2, #3. Soil + inoculation with the AMF strain G. cubense/INCAM-4) and #4. Soil + NPK fertilization at plant establishment application of NPK (25, 40 y 120 kg ha-1 de N, P2O5 y K20) + N at each cut at 70% of the initial dose. The inoculation with AMF was simultaneous for all treatments. A establishment cut and five successive cuts were performed, with 51.33 average days between them. The biomass production, the content of gross protein of L. leucocephala in each harvest and the cumulative total, as well as mycorrhizal effectiveness, were quantified. L. leucocephala positively responded to F. mosseae/INCAM-2 inoculation. Biomass production for cut increased between 31,50 % (Treatment #2) y 19,40 % (Treatment #3) with respect to control treatment. Inoculation with F. mosseae/INCAM-2 showed higher mycorrhizal effectiveness. The highest value in gross protein was obtained in the variant with mineral fertilization and the inoculated variants overcame the control treatment, with better performance than treatment # 2 ( Soil+ Funneliformis mosseae/INCAM-2).
Article visits 206 | PDF visits
Downloads
- Aguirre, J. F., Gálvez, A. L. y Ibarra, J. C. 2018. Growthof Leucaena leucocephala (Lam.) de Wit biofertilized with arbuscular mycorrhizal fungi in the nursery. Revista Chapingo Serie Ciencias Forestales y del Ambiente, 24(1): 49-58.
- Bardgett, R. D., Bullock, J. M., Lavorel, S., Manning, P., Schaffner, U., Ostle, N., Chomel, M., Durigan, G., Fry, E. L., Johnson, D., Lavallee, J. M., Le Provost, G., Luo, S., Png, K., Sankaran, M., Hou, X., Zhou, H., Ma, L., Ren, W. y Shi, H. 2021. Combatting global grassland degradation. Perspectives. https://doi.org/10.1038/s43017-021-00207-2
- Friedrich, T. 2015. Agricultura Climáticamente Inteligente, una estrategia para la sostenibilidad productiva; Memorias SISA 2015, II Seminario Internacional de Sanidad Agropecuaria, 18-22 de Mayo 2015, Varadero, Cuba, Avances y Retos de la Sanidad Agropecuaria en el Siglo XXI, CENSA; pp. 207-210. https://doczz.es/doc/14220/memorias-sisa-2015
- Funes, F. R. 2016. Integración agroecológica y soberanía energética. En: F. Funes-Aguilar y L. L. Vázquez-Moreno, eds. Avances de la agroecología en Cuba. Matanzas, Cuba: EEPF Indio Hatuey. 403-420.
- FAO. 2017a. Directrices voluntarias para la gestión sostenible de los suelos. Organización de las Naciones Unidas para la Alimentación y la Agricultura Roma, Italia: 1-26.
- FAO 2017b. Producción animal. Disponible en: http://www.fao.org/animal-production/es/
- Gaviria, X., Naranjo, J. F. y Barahona, R. 2015. Nutritional quality and fractionation of carbohydrates and protein in the forage components of an intensive silvopastoral system. Pastos y Forrajes. 38 (2):194-201.
- González, P. J., Ramírez, J. F., Rivera, R., Hernández, A., Plana, R. y Crespo, G. 2015. Management of arbuscular mycorrhizal inoculation for the establishment, maintenance and recovery of grasslands. Cuban Journal of Agricultural Science. 49 (4): 535-540. http://www.redalyc.org/articulo.oa?id=193045908016
- Garzón, L. P. 2016. Importancia de las micorrizas arbusculares (MA) para un uso sostenible del suelo en la Amazonia colombiana. Revista Luna Azul (42):1-19. http://www.redalyc.org/articulo.oa?id=321744162010
- Herrera, R. A., Hamel, C., Fernández, F., Ferrer, R. L. y Furrazola, E. 2011. Soil–strain compatibility: the key to effective use of arbuscular mycorrhizal inoculants?. Mycorrhiza 21(3): 183-193. https://doi.org/10.1007/s00572-010-0322-6
- Hernández, A., Pérez, J. M., Bosch, D. y Castro N. 2015. Clasificación de los suelos de Cuba. Mayabeque, Cuba: Instituto Nacional de Ciencias Agrícolas, Instituto de Suelos, Ediciones INCA.
- Janos, D. P. 2007. Plant responsiveness to mycorrhizas differs from dependence upon mycorrhizas. Mycorrhiza 17:75–91 Doi: 10.1007/s00572-006-0094-1
- Jung S. C., Martinez-Medina, A., Lopez-Raez, J. A. y Pozo, M. J. 2012. Mycorrhiza-Induced Resistance and Priming of Plant Defenses. J Chem Ecol 38: 651–664 Doi: 10.1007/s10886-012-0134-6
- Larimer, A. L., Clay, K. y Bever, J. D. 2014. Synergism and context dependency of interactions between arbuscular mycorrhizal fungi and rhizobia with a prairie legume. Ecology. 95:1045–1054.
- Le Mire, G., Nguyen, M.L., Fassotte, B., du Jardin, P., Verheggen, F., Delaplace, P. y Jijakli, M.H. 2016. Review: Implementing Plant Biostimulants and Biocontrol Strategies in the Agroecological Management of Cultivated Ecosystems. Biotechnology Agronomy. Society. Enviromental. 20(S):299-313. https://doi.org/10.25518/1780-4507.12717
- Lehmann, A., Leifheit, E. F. y Rillig, M. C. 2017. Mycorrhizas and Soil Aggregation. In C. Johnson,C. Gerhing & J. Jansa (Eds.), Mycorrhizal Mediation of Soil. Freie Universität Berlin: 241-262 https://doi.org/10.1016/B978-0-12-804312-7.00014-0
- Murgueitio, E., Flores, M., Calle, Z., Chará, J., Barahona, R., Molina, C. y Uribe, F. 2015. Productividad en sistemas silvopastoriles intensivos en América Latina. Pp. 59-101 En: Sistemas Agroforestales. Funciones productivas, socioeconómicas y ambientales. Serie Técnica Informe Técnico 402, CATIE, Turrialba, Costa Rica. Fundación CIPAV. Cali, Colombia. 454pp.
- Martínez, Y., Osorio, N. y Garrido, J. 2019. Efectividad de hongos micorrizo-arbusculares nativos en suelos con diferentes usos agropecuarios. Revista MVZ Córdoba 24(2): 7256-7261. https://doi.org/10.21897/rmvz.1703
- Ojeda, L., Furrazola, E. y Hernández, C. 2014 Micorrizas arbusculares en leguminosas de la empresa pecuaria El Tablón, Cuba. Pastos y Forrajes 37(4): 392-398. http://www.redalyc.org/articulo.oa?id=269133842003
- Ojeda, L., Furrazola, E. y Hernández., C. 2015. Respuesta de Leucaena leucocephala cv. Perú a la aplicación de diferentes dosis de MicoFert agrícola. Pastos y Forrajes 38(3): 176-182. http://www.redalyc.org/articulo.oa?id=269141594004
- Ortas, I. y Rafique, M. 2017. The Mechanisms of Nutrient Uptake by Arbuscular Mycorrhizae. In A. Varma, R. Prasad & N. Tuteja (Eds.), Mycorrhiza - Nutrient Uptake, Biocontrol, Ecorestoration (pp. 1- 20). Springer. Amity Institute of Microbial Technology Amity University Uttar Pradesh Noida, Uttar Pradesh India. https://doi.org/10.1007/978-3-319-68867-1_3
- Ojeda, L., González, P. J., Rivera, R., Furrazola, E., de la Rosa, J. J., Hernández, M. E., Rodríguez, Y.I. y Rodríguez, C. 2018. Inoculación de Canavalia ensiformis con hongos micorrízico arbusculares en la fase de establecimiento. Pastos y Forrajes. 41 (3):189-195. https://www.redalyc.org/journal/2691/269158218005/html/
- Paneque, V. M., Calaña, J. M., Calderón, M., Borges, Y., Hernández, T., Caruncho, M. 2010. Manual de técnicas analíticas para análisis de suelo, foliar, abonos orgánicos y fertilizantes químicas. San José de las Lajas Instituto Nacional de Ciencias Agrícolas. Cuba. 157.
- Pentón. G., Oropesa, K. y Peñalver, P.L. 2013. Multiplicación de propágulos infectivos HMA en una plantación de morera (Morus alba L.). Pastos y Forrajes 36(1): 22-27. http://www.redalyc.org/articulo.oa?id=269127587002
- Pachas, N., Radrizzani, A., Murgueitio, E., Uribe, F., Zapata., A., Chará, J., Ruiz, T., Escalante, E., Mauricio, R. y Ramírez. 2019. Establecimiento y manejo de leucaena en América Latina, Tropical Grasslands-Forrajes Tropicales 7(2):127–132. https://doi.org/10.17138/tgft(7)127-132
- Rivera, R. y Fernández, K. 2003. Bases científico-técnicas para el manejo de los sistemas agrícolas micorrizados eficientemente. En: Rivera, R. y Fernández, K. Eds. Manejo efectivo de la simbiosis micorrízica, una vía hacia la agricultura sostenible.Estudio de caso: el Caribe. INCA. La Habana, 166.
- Rodríguez, Y., Dalpé, Y., Séguin, S., Fernández, K., Fernández, F. y Rivera, R. 2011. Glomus cubense sp. nov. an arbuscular mycorrhizal fungus from Cuba. Mycotaxon 118 (1):337-384. https://doi.org/10.5248/118.337
- Rivera Espinosa, R., Martín Alonso, G., Simó González, J., Pentón Fernández, G., Joao, J.P., García Rubido, M., Ramírez Pedroso, J., González, P. J., Ruíz Martinez, L., Hernández Jiménez, A., Tamayo Aguilar, Y., Bustamante González, C., Reyes Rosseaux, R., Roberto Fundora, L., Crespo Flores, G. y Aida Medina Carmona, A. 2017. Bases y beneficios del manejo conjunto de Canavalia ensiformis e inoculantes micorrízicos arbusculares en los sistemas de suministro de nutrientes de diferentes cultivos. San José de las Lajas: Ediciones INCA.
- Rillig, M. C., Aguilar-Trigueros, C. A., Camenzind, T., Cavagnaro, R. T., Degrune, F., Hohmann, P., Daniel, R., Lammel, D. R., Mansour, I., Roy, J., van der Heijden, M. G. A. y Yang, G. 2019. Why farmers should manage the arbuscular mycorrhizal simbiosis. New Phytologist, 222(3), 1171-1175. https://doi.org/10.1111/nph.15602
- Restrepo, K, J., Montoya, M, I., Henao, P., Gutiérrez, L. A. y Molina, L, P. 2019. Caracterización de hongos micorrízicos arbusculares de suelos ganaderos del trópico alto y trópico bajo en Antioquia, Colombia. IDESIA 37(1): 35-44.
- Rivera, R., Martin, G., Simo, J., Pentón, G., García, M., Ramíerez, J., González, P. J., Joao, J. P., Ojeda, L., Tamayo, Y. y Bustamante, C. 2020. Benefits of Joint Management of Green manure and Mycorrhizal Inoculants in Crop production. Tropical and Subtropical Agroecosystems 23: #97. file:///Users/unicordoba/Downloads/3294-14798-4-PB.pdf
- Rivera, R., González, P. J., Ruiz-Martínez, L., Martin, G. y Cabrera, A. 2023. Strategic Combination of Mycorrhizal Inoculants, Fertilizers and Green Manures Improve Crop Productivity. Review of Cuban Research. In Q.S. Wu, Y. N. Zou, Y. J. He & N. Zhou (Eds.), New Research on Mycorrhizal Fungus (pp. 55-112). Nova Publishers. Doi:10.52305/GLXN2905
- Schüβler, A. y Walker, C. 2011. Evolution of the ‘Plant-Symbiotic’ Fungal Phyllum Glomeromycota. Evolution of fungi and fungal-like organisms. In: Pöggeler S, Wöstemeyer J, editors. The Mycota XIV. Heidelberg, Berlin: Springer-Verlag; p. 163-85.
- Simó, J., Rivera, R., Ruiz, L. A. y Espinosa, E. 2016. Necesidad de reinoculación micorrízica en el trasplante del banano en áreas con precedente de canavalia inoculada con HMA. Centro Agrícola 43 (2):28-35.
- Sadiqin, A., Tuheteru, FD, Arif, A., Husna, H. y Albasri, A. 2023. La eficacia de los fertilizantes que promueven el crecimiento hormonal en el aumento de la producción de esporas de hongos micorrízicos arbusculares. Revista de micorrizas tropicales 2 (1): 1–10. https://journal.ami-ri.org/index.php/JTM/article/view/34