Hongos micorrícicos arbusculares y Trichoderma en Capsicum annuum disminuyen el daño inducido por Meloidogyne incognita
Arbuscular mycorrhizal fungi and Trichoderma in Capsicum annuum decrease the damage induced by Meloidogyne incognita

Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial 4.0.
Mostrar biografía de los autores
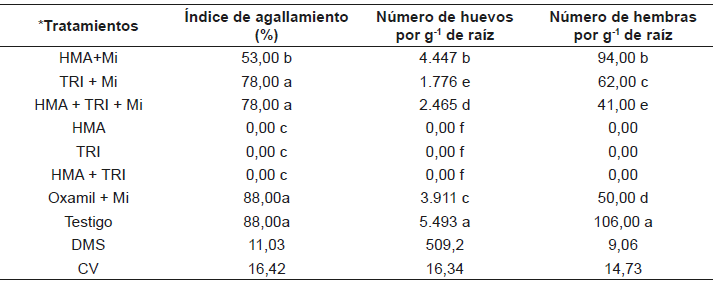
Se evaluaron en invernadero consorcios de especies nativas de hongos micorrícicos arbusculares (HMA) y cepas de Trichoderma (TRI) en el control del nematodo endoparásito sedentario, Meloidogyne incognita (Mi) en Capsicum annuum. Plantas inoculadas con consorcios de HMA y TRI se inocularon con Mi, se evaluaron ocho tratamientos: i) HMA, ii) TRI, iii) HMA+ TRI, iv) HMA + Mi, v) TRI + Mi, vi) HMA + TRI + Mi, vii) Nematicida Oxamil + Mi y viii) Testigo, con 15 repeticiones dispuestas en un diseño experimental completamente al azar. Después de 166 días, el tratamiento HMA + Mi, causó el menor índice de agallamiento (53 %). El menor número de huevos se obtuvo con TRI + Mi y HMA +TRI + Mi con reducciones de 68 y 55 % con relación al control, y de 54 y 37 %, en comparación con el Oxamil + Mi. La reducción de hembras se logró con los tratamientos HMA + Mi en un 11 %, TRI + Mi en un 42 % y HMA + TRI en un 61 % con relación al testigo. Los tratamientos que no incluyeron la inoculación de Mi, presentaron raíces sanas y mayor promedio de las variables agronómicas. Los tratamientos HMA + Mi, HMA + TRI + Mi, que incluyeron la inoculación del nematodo, promovieron el mayor crecimiento de las plantas, con efectos iguales al obtenido con el Oxamil + Mi. Los consorcios promovieron el crecimiento de las plantas y ejercieron efectos de control antagónico en contra de M. incognita superiores al del nematicida.
Visitas del artículo 446 | Visitas PDF
Descargas
- Avio, L., Sbrana, C., Giovannetti, M. y Frassineti, S. 2017. Arbuscular mycorrhizal fungi affect total phenolics content and antioxidant activity in leaves of oak leaf lettuce varieties. Scienta Horticulturae. 224: 265-271. https://doi.org/10.1016/j.scienta.2017.06.022
- Basto, P. C. I. y Hernández, P. C. D. 2020. El chile dulce, más allá de su diversidad y sus formas. Desde el Herbario CICY 12: 164-168. https://www.cicy.mx/sitios/desde_herbario/2020
- Cauich, C. R., Tun, S. J. M., Cristobal, A. J., Herrera, P. E., Andueza, N. R. y Lozano, C. M. G. 2023. Evaluación de consorcios micorrícicos arbusculares nativos en interacción con niveles de fósforo en la promoción del crecimiento y fotosíntesis de Stevia rebaudiana Bertoni. Biotecnia. 25(1): 67-80. https://doi.org/10.18633/biotecnia.v25i1.1765
- Cetz, C. J., Cristóbal, A. J., Tun, S. J., Peraza, L. A. y Candelero de la Cruz, J. 2018. Especies nativas de Trichoderma spp. y su actividad antagónica contra Meloidogyne incognita en Solanum Iycopersicum L. Investigación y Ciencia de la Universidad Autónoma de Aguascalientes. 26(73): 5-12. https://doi.org/10.33064/iycuaa201873136
- Chen, D. Q., Hou, L, Jia. y Sun, K. 2021. Combined use of two Trichoderma strains to promote growth of Pakchoi (Brassica chinensis L.). Agronomy. 11(4): 726. https://doi.org/10.3390/agronomy11040726
- Cristóbal, A. J., Herrera, P. E., Reyes, O. V., Ruiz, S. E., Tun, S. J. M. y Celis, R. T. 2010. Glomus intraradices para el control de Meloidogyne incognita (Kofoid & White) Chitwood en condiciones protegidas. Fitosanidad. 14(1): 25-29. http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1562-30092010000100004
- Cristóbal, A. J., Moo, K. F.A., Tun, S. J., Reyes, R. J. y Gamboa, A. M. 2021. Efecto de la interacción dual de especies de Trichoderma en el crecimiento de Capsicum chinense Jacq. 2021. Agrociencias. 55: 681-693. https://doi.org/10.47163/agrociencia.v55i8.2661
- Cristóbal, A. J., Lima, B. A., Pinzón, L. L., Tun, S. J. M. y Herrera, P. E. 2022. Hongos micorrízicos arbusculares aceleran el tiempo de crecimiento de portainjertos de guanábana (Annona muricata L.). Ecosistemas y Recursos Agropecuarios. 9(1): e3326. https://doi.org/10.19136/era.a9n1.3226
- Cubillos, H. J., Valero, N. y Mejía, L. 2009. Trichoderma harzianum como promotor del crecimiento vegetal del maracuyá (Passiflora edulis var. Flavicarpa Degener). Agronomía Colombiana. 27: 81-86. https://www.redalyc.org/pdf/1803/180314730011.pdf
- Diagne, N., Ngom, M., Brahima D. P., Fall, D., Hocher, V. y Svistoonoff, S. 2020. Roles of arbuscular mycorrhizal fungi on plant growth and performance: Importance in biotic and abiotic stressed regulation. Diversity. 2(10): 370. https://doi.org/10.3390/d12100370
- Gerdeman, J. y Nicholson, T. 1963. Spores of mycorrhizal endogene species extracted from soil gy wet sieving and decanting. Transactions of the British Mycologycal Society. 46: 235-244. http://dx.doi.org/10.1016/S0007-1536(63)80079-0
- Herrera, P. E., Cristóbal, Alejo, J., Tun, S. J. M., Góngora, J. J. A. y Lomas, B. T. C. 2011. Nematofauna nociva (Meloidogyne spp.) en cultivos hortícolas tropicales: distribución y perspectivas de manejo en Yucatán. En: (Ed) Gamboa, A. M y Rojas, H. R. Recursos genéticos microbianos de la zona golfo sur-sureste de México. SUBNARGEN. Edit. Morevalladolid S de R. L. de C. V. Pp. 125-136. ISBN: 978-607-424-274-4
- Herrera, P. E., Cristóbal, A. J. y Ramos, Z. J. 2017. Trichoderma strains as growth promoters in Capsicum annuum and as biocotrol agents in Meloidogyne incognita. Chilean Journal of Agricultural Research. 77(4): 318-324. http://dx.doi.org/10.4067/S0718-58392017000400318.
- Herrera, P. E., Ramos, Z. J., Cristóbal, A. J., Tun, S. J. y Reyes, R. A. 2018. Species of Trichoderma antagonistic to the root knot nematode (Meloidogyne incognita) in habanero pepper. Phyton, 87: 7-13. https://doi.org/10.32604/phyton.2018.87.007
- Herrera, P. E., Ramos, Z. J., Basto, P. C. y Cristóbal, A. J. 2021a. Sweet pepper (Capsicum annuum) response to the inoculation of native arbuscular mycorrhizal fungi and the parasitism of root-knot Meloidogyne incognita. Revista Bio Ciencias (8): e982. https://doi.org/10.15741/revbio.08.e982
- Herrera, P. E., Hernández, C. L., Cristóbal, A. J., Parra, T. V. y Ramos, Z. J. A. 2021b. Native mycorrhizal fungi induce positive and differential effects on initial growth in Capsicum spp. Acta Agrícola y Pecuaria. 7: E0071021. http://aap.uaem.mx/index.php/aap/issue/view/16
- Medina, M. C. O., Medina, C. M. G., Torres, C. R., Carvajal, S. A. y Tovar, S. A. 2018. Alteraciones histológicas causadas por el nematodo agallador Meloidogyne incognita en raíces de betabel (Beta vulgaris L.). Polibotánica. (46): 193-202. https://doi.org/0.18387/polibotanica.46.12
- Moo, K. F.A., Cristóbal-Alejo, J., Andrés, M.F., Martín, J., Reyes, F., Tun-Suárez, J.M. y Gamboa-Angulo. M. 2022. In vitro assessment of organic and residual fractions of nematicidal culture filtrates from thirteen tropical Trichoderma strains and metabolic profiles of most active. Journal of Fungi. 8(1): 82; https://doi.org/10.3390/jof8010082
- Polanco, R. A. G., Magaña, C. T. V., Cetz, I. J. y Quintal, L. R. 2019. Uso de agroquímicos cancerígenos en la región agrícola de Yucatán, México. Centro Agrícola. 46(2): 72-83. http://scielo.sld.cu/scielo.php?script=sci_abstract&pid=S025357852019000200072&lng=en&nrm=iso&tlng=es
- Poveda, J., Abris, U. P. y Escobar, C. 2020. Biological control of plant-parasitc neamtodes by filamentous fungi inducers of resistance: Trichoderma, mycorrhizal and endophytic fungi. Frontiers in Microbiology. 11(992): 1-14. https://doi.org/10.3389/fmicb.2020.00992
- Phillips, G. M. y Hayman, D. S. 1970. Improved procedures for clearing roots and staining parasitic and vesicular-arbuscular mycorrhizal fungi for rapid assessment of infection. Transactions British Mycological Society. 55: 158-161. http://dx.doi.org/10.1016/S0007-1536(70)80110-3
- Rizvi, R., Mahmood, I. y Ansari, S. 2018. Interaccion between plant symbiots, bio-organuc wasted and antagonistic fungi in the management of Meloidogyne incognita infecting chickpea. Journal of the Saudi Society of Agricultural Sciences. 17: 424-434. https://doi.org/10.1016/j.jssas.2016.10.002
- SIAP (Servicio de Información Agroalimentaria y Pesquera). 2022. Por estado. Yucatán https://nube.siap.gob.mx/cierreagricola/
- Sharman, M., Saini, I., Kaushik, P., Mohamed, M., Al Balawi, T. y Alam, P. 2021. Mycorrhizal fungi and Pseudomonas fluorecens application reduces root-knot nematode (Meloidogyne javanica) infestation in eggplant. Saudi Journal of Biological Sciences. 28(7): 3685-3691. https://doi.org/10.1016/j.sjbs.2021.05.054
- Taylor, A. y Sasser, J. 1983. Identificación y control de los nematodos de nódulo de la raíz (especies de Meloidogyne). Proyecto Internacional de Meloidogyne (MIP). Departamento de Fitopatología. Universidad del Estado de Carolina del Norte-EEUU. 89-95. https://pdf.usaid.gov/pdf_docs/pnaaq245.pdf
- Vergara, C., Campos, A. K. E., de Souza, R., Schultz N., Junior L. V. M. y Zilli, E. J. 2019. Plant-mycorrhizal fungi interaction and response to inoculation with different growth-promoting fungi. Pesquisa Agropecuaria Brasileira Brasilia. 54: e25140. https://doi.org/10.1590/S1678-3921.pab2019.v54.25140
- Weng, W., Yan, J., Zhou, M., Yao, X., Gao, A., Ma, C., Cheng, J. y Ruan, J. 2022. Roles of arbuscular mycorrhizal fungi as a biocontrol agent in the control of plant diseases. Microorganisms. 10:1266. https://doi.org/10.3390/ microorganisms10071266



















